
【题目】下图所示为工业合成氨的流程图。有关说法错误的是

A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C. 步骤③、④、⑤均有利于提高原料的转化率
D. 产品液氨除可生产化肥外,还可用作制冷剂
科目:高中化学 来源: 题型:
【题目】一种特殊的热激活电池示意图如下。该电池总反应为:PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ,下列说法不正确的是

A. Ca电极发生氧化反应
B. 负极的电极反应:Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s)
C. 可用 LiCl 和 KCl 水溶液代替无水 LiCl﹣KCl
D. 当无水LiCl﹣KCl混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
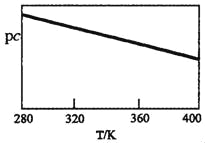
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
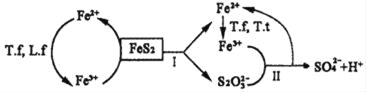
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。

(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atmmol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的CuSO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图完成回收硫酸亚铁和铜的简单实验方案,回答下列问题:(图中所加试剂均为过量,流程图中无需填写)

(1)操作f的名称为____________,物质c的成分_________________
(2)试剂a的化学式为_____,加入该试剂所发生的化学方程式为______________。
(3)请写出c→h+k的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用木炭粉和水蒸气在高温条件下反应制取H2,同时生成CO2。某学习小组在实 验室中模拟H2的工业生产过程并测定其产率,实验装置如下所示。

(1)仪器a的名称为_______________。仪器b的作用为____________________________。
(2)实验步骤:连接好装置,检查装置的气密性;______________________(按顺序填入下列步骤的序号)。
①向装置A、B、C、D中分别加入相应试剂,打开活塞K,通入一段时间N2。
②加热装置B处硬质玻璃管。
③关闭活塞K,连接盛有适量水的量气管。
④点燃装置A处酒精灯。
⑤待装置B处木炭粉完全反应后,停止加热。
(3)装置B处硬质玻璃管中发生的所有反应的化学方程式为______________________。
(4)读取B气管读数时,应注意的事项为冷却至室温、___________、视线与凹液面最低点相切;若仰视读取初始读数,则导致所测气体的体积___________(填“偏大”或“偏小”)。
(5)实验后所域取的气体体积为V2 mL标准状况);取装置C中液体,加入足量BaCl2溶液,过滤、洗涤,将滤液和洗涤液合并,以甲基橙为指示剂,用0.1000molL-1的盐酸标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V3mL。
①达到滴定终点时的现象为____________________________________________。
②H2的产率为______________________(列出代数式即可)。
③还可通过___________,得出装置C中所吸收产物的物质的量。
(6)从安全角度考虑,该实验装置的缺陷为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2p轨道上最多只能排布6个电子,其依据的规律是__________________。
(2)氧元素基态原子核外未成对电子数为________个,第三周期中有两个成单电子的元素符号________(填一种即可),M层上有2对成对电子的原子最外层共有________种不同运动状态的电子。
(3)1~36号元素原子中未成对电子数为2的元素符号及价电子排布式________________。
(4)X元素的价电子排布式是4s24p5,X元素的符号是________。
(5)某元素的原子序数为33,该元素原子的价电子排布式为________,该元素原子核外有________个电子层,________个能级,________个原子轨道。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)![]() pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体是日常生活中的一种混合物。
(1)下列有关胶体的说法中,不正确的是(___________)
A. 胶体、溶液、浊液的分类依据是分散质微粒直径大小
B. “卤水点豆腐”、“黄河入海口处的沙洲”都与胶体的聚沉有关
C. 向1 mol/L氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体
D. 可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体
(2)在水泥和冶金工业常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种做法应用的原理是______。
(3)某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
①写出制备Fe(OH)3胶体的化学反应方程式:________。
②取少量制得的胶体加入试管中,再加入少量饱和氯化钠溶液,观察到的现象____,这种现象称为胶体的____。
③![]() 胶体能稳定存在的主要原因是____________。
胶体能稳定存在的主要原因是____________。
A.胶粒直径小于1nm B.胶粒带正电荷 C.胶粒作布朗运动 D.胶粒能透过滤纸
(4)有关制备Fe(OH)3胶体实验方案评价。某同学在制备Fe(OH)3胶体时将蒸馏水改为自来水煮沸后进行实验,该同学是否能得到胶体?______,(能或不能)理由_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com