
����Ŀ����ҵ����ľ̿�ۺ�ˮ�����ڸ��������·�Ӧ��ȡH2��ͬʱ����CO2��ijѧϰС����ʵ ������ģ��H2�Ĺ�ҵ�������̲��ⶨ����ʣ�ʵ��װ��������ʾ��

��1������a������Ϊ_______________������b������Ϊ____________________________��
��2��ʵ�鲽�裺���Ӻ�װ�ã����װ�õ������ԣ�______________________����˳���������в������ţ���
����װ��A��B��C��D�зֱ������Ӧ�Լ�������K��ͨ��һ��ʱ��N2��
�ڼ���װ��B��Ӳ�ʲ����ܡ�
�۹رջ���K������ʢ������ˮ�������ܡ�
�ܵ�ȼװ��A���ƾ��ơ�
�ݴ�װ��B��ľ̿����ȫ��Ӧ��ֹͣ���ȡ�
��3��װ��B��Ӳ�ʲ������з��������з�Ӧ�Ļ�ѧ����ʽΪ______________________��
��4����ȡB���ܶ���ʱ��Ӧע�������Ϊ��ȴ�����¡�___________�������밼Һ����͵����У������Ӷ�ȡ��ʼ����������������������___________���ƫ��ƫС������
��5��ʵ�������ȡ���������ΪV2 mL��״������ȡװ��C��Һ�壬��������BaCl2��Һ�����ˡ�ϴ�ӣ�����Һ��ϴ��Һ�ϲ����Լ���Ϊָʾ������0.1000molL-1���������Һ�ζ����ﵽ�ζ��յ�ʱ�����ı���Һ�����ΪV3mL��
�ٴﵽ�ζ��յ�ʱ������Ϊ____________________________________________��
��H2�IJ���Ϊ______________________���г�����ʽ���ɣ���
�ۻ���ͨ��___________���ó�װ��C�������ղ�������ʵ�����
��6���Ӱ�ȫ�Ƕȿ��ǣ���ʵ��װ�õ�ȱ��Ϊ_________________________________��
���𰸡��ƾ���� ƽ��ѹǿ�����װ���Ƿ���ڶ��� �٢ۢڢܢ� C+H2O��g��![]() CO+H2��C+2H2O��g��
CO+H2��C+2H2O��g��![]() CO2+2H2 ����������������Һ����ƽ ƫ�� ���������һ������ʱ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ
CO2+2H2 ����������������Һ����ƽ ƫ�� ���������һ������ʱ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ 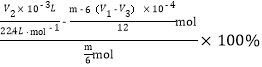 �ⶨϴ��������BaCO3������ ȱ�ٷ�����װ��
�ⶨϴ��������BaCO3������ ȱ�ٷ�����װ��
��������
ģ��H2�Ĺ�ҵ�������̣�ľ̿��ˮ������Ӧ��Aװ���ṩˮ��������B����ľ̿��Ӧ���ɶ�����̼��������C��NaOH��Һ����CO2��Dװ�ø��E��ˮ�����������ڲ���ʡ�
��1����װ��ͼ![]() ֪����a������Ϊ�ƾ���ơ���������b��������ѹ��ͨ����ƽ��ѹǿ�������װ���Ƿ���ڶ�������Ϊ�ƾ����ƽ��ѹǿ�����װ���Ƿ���ڶ�����
֪����a������Ϊ�ƾ���ơ���������b��������ѹ��ͨ����ƽ��ѹǿ�������װ���Ƿ���ڶ�������Ϊ�ƾ����ƽ��ѹǿ�����װ���Ƿ���ڶ�����
��2������ʵ��Ŀ�ĺ�ʵ��ԭ�������Ӻ�װ�ã����װ�õ������Ժ�Ӧ���еIJ���Ϊ��װ��A��B��C��D�зֱ������Ӧ���Լ�������K��ͨ��һ��ʱ��N2���ž�װ���еĿ������ٹرջ���K������ʢ������ˮ�������ܣ���ȼװ��B���ƾ����Ԥ��ľ̿�ۣ��Է�ֹˮ��������Ӳ�ʲ����ܺ�������ʹľ̿�۳�ʪ������ˮ������Ӧ��Ȼ���ȼװ��A���ƾ��ƣ��ṩˮ��������װ��B��ľ̿����ȫ��Ӧ��ֹͣ���ȣ�����ȷ��ʵ�鲽��Ϊ�٢ۢڢܢ�����Ϊ�٢ۢڢܢ���
��3��װ��B��Ӳ�ʲ������п��ܷ���C��ˮ�����ڸ�������������CO��H2�ķ�Ӧ��C��ˮ�����ڸ�������������CO2��H2�ķ�Ӧ���仯ѧ����ʽ�ֱ�ΪC+H2O��g��![]() CO+H2��C+2H2O��g��
CO+H2��C+2H2O��g��![]() CO2+2H2��
CO2+2H2��
��4����ȡ�����ܶ���ʱ��Ӧע�������Ϊ��ȴ�����¡�����������������Һ����ƽ��ƽ�Ӷ����������Ӷ�ȡ��ʼ�����������ƫ����������������ƫ��Ϊ����������������Һ����ƽ ƫ��
��5�������ȵı�ɫ��ΧΪ3.14.4���ʴﵽ�ζ��յ�ʱ������Ϊ���������һ������ʱ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ����Ϊ���������һ������ʱ����Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ��
��������Ϣ֪����Ӧ���ɵ�n��CO2��=��V1��l0-3 L��0.1000molL-l-V3��10-3L��0.1000molL-1��/2=![]() mol��mgľ̿��������n��C��=
mol��mgľ̿��������n��C��=![]() mol����̼ԭ���غ�֪��������������N��CO��=[
mol����̼ԭ���غ�֪��������������N��CO��=[![]() ]mol=
]mol=![]() mol���ɻ�ѧ����ʽC+2H2O��g��
mol���ɻ�ѧ����ʽC+2H2O��g��![]() CO2+2H2�������H2�����۲���Ϊ��
CO2+2H2�������H2�����۲���Ϊ��![]() ��2��mol=
��2��mol=![]() mol����H2�IJ���Ϊ
mol����H2�IJ���Ϊ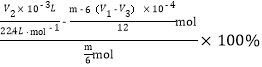 ��
��
��ͨ���ⶨϴ��������BaCO3���������ɵó����� ��CO2����������һ�������H2�IJ��ʡ���Ϊ�ⶨϴ��������BaCO3��������
����װ�����Ȳ����Ȼ�װ��������ѹǿ��Сʱ����������������Ϊȱ�ٷ�����װ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������,ij��Ӧ�ﵽƽ��,ƽ�ⳣ��K=![]() ������ʱ,�¶����ߣ�H2Ũ�ȼ�С������˵����ȷ����( )
������ʱ,�¶����ߣ�H2Ũ�ȼ�С������˵����ȷ����( )
A. �����¶�,����Ӧ��������,�淴Ӧ���ʼ�С
B. �÷�Ӧ�Ļ�ѧ����ʽΪCO+H2O![]() CO2+H2
CO2+H2
C. ���º�����,����ѹǿ,H2Ũ��һ����С
D. �÷�Ӧ���ʱ�Ϊ��ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ƿ�����ȵ����壬��ͬ�¡�ͬѹ��ƿ������Ĺ�ϵһ����ȷ����

A.ԭ�������
B.�ܶ����
C.�������
D.���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ���������ʵ��װ����ͼ��ʾ���г�װ������ȥ����

����˵������ȷ���ǣ� ��
A. ˮԡ���ȵ��ŵ�Ϊʹ��Ӧ�����Ⱦ��ȡ��������¶�
B. ��Ũ���ᡢŨ����ͱ����ʱ��Ӧ��Ũ�����м���Ũ���ᣬ����ȴ�����º����û������뱽��
C. ʵ������з�������b��δ�������Ƭ������ȴ��
D. ��Ӧ��ȫ��������a��b����õ���Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ�����á��͡���̼���á���Ŀǰ���ܹ�ע�Ŀ��⣬�����̼�����仯������ۺ����� ��Ϊ�о����ȵ㡣
��1��������ʵ�У��������Ƚ�̼Ԫ�غ���Ԫ�صķǽ�����ǿ������____________������ĸ����
A��SO2����Ư���Զ�CO2û��
B������H2SO3����Na2C03��Ӧ����NaHCO3
C��SO2��ʹ����KMnO4��Һ��ɫ��CO2����
D��Na2CO3��Һ�Լ��ԣ���Na2SO4��Һ������
��2��ͨ����ѭ��������Դ�ۺ����õķ�Ӧϵͳ��ԭ������ͼ��ʾ��

ϵͳ��������ȡ�������Ȼ�ѧ����ʽΪ________________________��
����ϵͳ�Ƶõ�����H2ʱ�����������ٵ���________________________��
��3����10L�����ܱ������г���2 molCO��1molSO2��������Ӧ2CO��g��+SO2��g��![]() S��g��+2CO2��g����CO��CO2��ƽ�����������
S��g��+2CO2��g����CO��CO2��ƽ�����������![]() �����¶ȣ�T���ı仯��ϵ����ͼ��ʾ��
�����¶ȣ�T���ı仯��ϵ����ͼ��ʾ��

��ͼ�б�ʾCO��ƽ������������¶ȵı仯��ϵ������Ϊ_____________������L1������L2������
��T1��ʱ��SO2��ƽ��ת����a1=_____________����Ӧ��ƽ�ⳣ��K1=_____________��
��ֻ�ı��������������ܼӿ�÷�Ӧ�ķ�Ӧ���ʣ���������CO��ƽ��ת���ʵ���_____________������ĸ����
A������ѹ��
B������һ������H2S
C������һ������SO2
D�������ʵ�����
������ʼ���ΪT1����10L���������г���2molCO��1molSO2���ظ�ʵ�飬�÷�Ӧ��ƽ�ⳣ��K2___��������������������=����K1������Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�����Ϊ95 g���Ȼ�þ�ܽ���0.2 Lˮ����ˮ���ܶȽ���Ϊ1 g/mL��ǡ�õõ��Ȼ�þ�ı�����Һ��������Һ���ܶ�Ϊ�� g/mL�����ʵ���Ũ��Ϊc mol/L���ܽ��Ϊs��NA��ʾ�����ӵ�������ֵ����������������ȷ������������
A. ������Һ�к���NA���Ȼ�þ����
B. ������Һ�����ʵ���Ũ��Ϊ5 mol/L
C. ������Һ���ܽ�ȿɱ�ʾΪ9500 c/��1000��-95c��
D. ������Һ�����������ɱ�ʾΪ95 ��/��1000c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������I����ͱ��ף����ٴ����õ�������ҩ���ϳ�·�����£�

��֪��R��R��R����������R������������ԭ�ӡ�
��. 
��. ![]()
��. 
�ش��������⣺
��1��F��G�ķ�Ӧ������_________________��
��2��A�Ļ�ѧ������_____________________��
��3���Լ�a�Ľṹ��ʽ_____________________��
��4��I�Ľṹ��ʽ_____________________��
��5��B��C��Ϊͬ���칹�壬д��B��D�Ļ�ѧ����ʽ_____________________��
��6��д��E��F�Ļ�ѧ����ʽ_____________________��
��7����A����һ���л������P��Ҫ�����Լ��ɺϳ�B����B�ĺϳ�·��Ϊ______��
���ýṹ��ʽ��ʾ�л�������ü�ͷ��ʾת����ϵ����ͷ�ϻ���ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ѳ�Ϊ��ʵ��ij��ѧ��ȤС����ʵ������ģ���������̣���Ӧ������������ը��������Ƶ�ģ��װ�����£�

����Ҫ����գ�
��1������F������______________��A�з�Ӧ�����ӷ�Ӧ����ʽ___________________��
��2��Bװ�������ֹ��ܣ��ٿ��������ٶȣ��ھ��Ȼ�������______________________��
��3��Ϊ�˳������������Dװ���е�ʯ�������ȸ���KI��ĩ������Ϊ�ܷɼ�ʯ��______����ܡ����ܡ�����
��4��Eװ�õ�����________��
A.�ռ����� B.�������� C.��ֹ���� D.�����Ȼ���
��5��Eװ���г�������������,�������л���,��E�з�����������ѷ�����_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100mLij���������Ļ����Һ�ֳ����ȷݡ�һ�ݼ������BaCl2��Һ����ַ�Ӧ��ó���2.33g����һ�ݼ���50mL1.0mol��L-1NaOH��Һ����ַ�Ӧ����Һ�� c(OH-)=0.1mol��L-1����Ӧ����Һ�����Ϊ100mL�����Լ��㣺
��1��ÿ����Һ������H2SO4�����ʵ���______________mol��
��2��ԭ�����Һ����������ʵ���Ũ��_____________mol��L-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com