
【题目】己知:①pOH=-lgc(OH-);②N2H4 +H2O![]() N2H5++OH-、N2H5++H2O
N2H5++OH-、N2H5++H2O![]() N2H62++OH-,分别对应有pOH1和pOH2。常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH随离子浓度变化的关系如图所示。下列叙述错误的是
N2H62++OH-,分别对应有pOH1和pOH2。常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH随离子浓度变化的关系如图所示。下列叙述错误的是
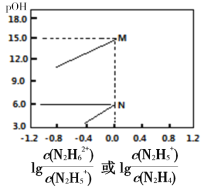
A.曲线M表示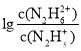 变化关系
变化关系
B.N2H4与硫酸形成的酸式盐的化学式为N2H5HSO4
C.pOH1>pOH2
D.反应N2H5+ + H2O ![]() N2H62+ + OH-的K=10-15
N2H62+ + OH-的K=10-15
【答案】BC
【解析】
M、N点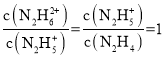 ,M点c(OH-)=10-15、N点c(OH-)=10-6,M点表示的电离平衡常数=10-15,N点表示的电离平衡常数=10-6;第一步电离常数大于第二步电离常数。
,M点c(OH-)=10-15、N点c(OH-)=10-6,M点表示的电离平衡常数=10-15,N点表示的电离平衡常数=10-6;第一步电离常数大于第二步电离常数。
A.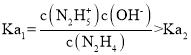 ,所以曲线M表示pOH与
,所以曲线M表示pOH与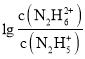 的变化关系,曲线N表示pOH与
的变化关系,曲线N表示pOH与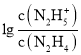 的变化关系,故A正确;
的变化关系,故A正确;
B.根据电离方程式可知,N2H4为二元碱,可以结合两个H+,与硫酸形成的酸式盐的化学式为N2H6(HSO4)2,故B错误;
C.推导可知pOH1=-lgKa1、pOH2=-lgKa2,Ka1>Ka2,所以pOH1<pOH2,故C错误;
D. 反应N2H5+ + H2O![]() N2H62+ + OH-为第二步反应,M点时
N2H62+ + OH-为第二步反应,M点时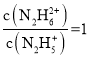 ,c(OH-)=10-15, K=
,c(OH-)=10-15, K=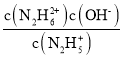 =10-15,故D正确;
=10-15,故D正确;
答案选BC。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】钠离子电池相比锂离子电池具有高安全、长寿命、低成本的特点,有望成为下一代电池。某钠离子电池放电时的总反应为Na(1-x)MO2+NaxCn═NaMO2+nC,如图表示其充电过程。有关该电池的说法错误的是( )
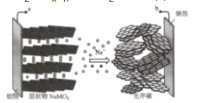
A.充电时,a与外加电源正极相连
B.放电时,外电路电子由b流向a
C.充电时,无序碳上发生的反应为nC+xNa++xe-═NaxCn
D.用该电池电解精炼铜,当电池中迁移1molNa+时,理论上可获得64g纯铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像布袋结构的烯烃分子,其形状和结构如图所示,有关说法不正确的是( )

A. 该烯烃的分子式为C5H4
B. 该分子所有碳原子在同一平面
C. 1 mol该有机物最多可与2 mol Br2发生加成反应
D. 与其互为同分异构体且只含三键的链烃不止—种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种杀虫剂,它可以通过以下步骤制备。
步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知 Fe3+对该反应有催化作用,其催化原理如图所示。
步骤 2:在制得的 CuCl2 溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
下列有关说法正确的是
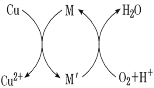
A.a、b、c之间的关系式为:a=b+c
B.图中 M、Mˊ分别为 Fe2+、Fe3+
C.步骤 1 充分反应后,加入少量 CuO 是为了除Fe3+
D.若制备 1 mol CuCl2,理论上消耗 11.2 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
I.用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=____kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成 H2O(g)],如图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。

①a、b两点化学反应速率分别用Va、Vb,表示,则Va ___Vb(填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K= ____________________。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g) ![]() CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512 K时,图中N点υ(正)<υ(逆)
(4)CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g) ![]() C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=![]()

①图3中投料比相同,温度T3>T2>T1,则该反应的焓变△H____0(填“>”、“<”)。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___________。
Ⅱ.甲醇的应用
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。

离子交换膜a为_____(填“阳膜”、“阴膜”),阳极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是
![]()
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体光催化CO2机理如图甲所示,设计成电化学装置如图乙所示,则下列说法正确的是
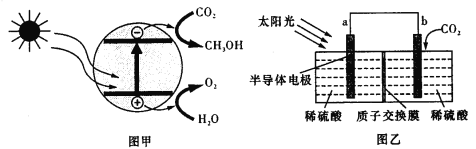
A.若导线上有4mol电子移动,则质子交换膜左侧产生22.4LO2
B.装置中进行的总反应一定是自发的氧化还原反应
C.图乙中的能量转化形式为:光能→电能→化学能
D.b极上的电极反应为:CO2+6H+-6e-![]() CH3OH+H2O
CH3OH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时有关物质的颜色和溶度积(Ksp)如下表:
物质 | AgCl | AgBr | AgI | Ag2S |
颜色 | 白 | 淡黄 | 黄 | 黑 |
Ksp | 1.8×10-10 | 7.7×10-13 | 1.5×10-16 | 1.8×10-50 |
下列叙述中不正确的是( )
A.向AgCl的白色悬浊液中加入0.1 mol/L KI溶液,有黄色沉淀产生
B.25 ℃时,利用表中的溶度积(Ksp),可以计算AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度
C.25 ℃,AgCl固体分别在等物质的量浓度NaCl、CaCl2溶液中溶解达到平衡,两溶液中,c(Ag+)和溶度积均相同
D.在5 mL 1.8×10-6 mol/L NaCl溶液中,加入1滴(20滴约为1 mL)1×10-3 mol/L AgNO3溶液,不能产生白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com