
【题目】已知丁酸(结构简式为:CH3CH2CH2COOH)跟乙酸具有相似的化学性质,丁醇(结构简式为:CH3CH2CH2CH2OH)跟乙醇具有相似的化学性质:
试回答下列问题:
(1)写出丁醇、丁酸与Na反应的化学方程式:
丁醇+钠:_____________________________________;
丁酸+钠:_____________________________________;
(2)写出丁酸与丁醇的酯化反应的化学方程式,注明反应条件。
______________________________________________。
【答案】 2CH3CH2CH2CH2OH+2Na![]() 2CH3CH2CH2CH2ONa+H2↑ 2CH3CH2CH2COOH+2Na
2CH3CH2CH2CH2ONa+H2↑ 2CH3CH2CH2COOH+2Na![]() 2CH3CH2CH2COONa+H2↑ CH3CH2CH2COOH+HOCH2CH2CH2CH3
2CH3CH2CH2COONa+H2↑ CH3CH2CH2COOH+HOCH2CH2CH2CH3![]() CH3CH2CH2COOCH2CH2CH2CH3+H2O
CH3CH2CH2COOCH2CH2CH2CH3+H2O
【解析】(1)丁醇含有羟基,和钠反应生成氢气,方程式为2CH3CH2CH2CH2OH+2Na→2CH3CH2CH2CH2ONa+H2↑;丁酸含有羧基,和钠反应生成氢气,方程式为2CH3CH2CH2COOH+2Na→2CH3CH2CH2COONa+H2↑:(2)丁酸与丁醇的酯化反应的化学方程式为CH3CH2CH2COOH+HOCH2CH2CH2CH3![]() CH3CH2CH2COOCH2CH2CH2CH3+H2O。
CH3CH2CH2COOCH2CH2CH2CH3+H2O。


科目:高中化学 来源: 题型:
【题目】某溶液只含下表离子中的几种,且各离子的物质的景浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH -、CI-、CO32-、SO42 - |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42- B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 泣液A中可能含有K+ D. 沉淀B中一定含有Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解

①填写仪器名称:a_____________、b_________。
②写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
③装置D中加入的试剂是__________。
④U型管G的作用为______________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是_________________。
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_____________________________________。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。

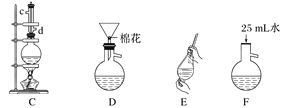
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是___________________,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时。
(2)B装置的冷凝管的主要作用是_____________,可否换为球形冷凝管 (填“可”或“否”)。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为_______________(填装置字母代号)。
(4)A中Na2CO3的作用是____________________;D装置的作用是___________________
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究苯与溴发生反应的原理,用如图所示装置进行了实验。根据相关知识回答下列问题:

(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在装置Ⅲ中可能观察到的现象是_________________________________________________。
(2)整套实验装置中能防止倒吸的装置有___(填装置序号)。
(3)你认为通过该实验,有关苯与溴反应的原理方面能得出的结论是___________________。
(4)本实验能不能用溴水代替液溴?____。
(5)采用冷凝装置,其作用是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:

已知反应:①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓) ![]() TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O
TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O![]() TiO2·nH2O+H2SO4。
TiO2·nH2O+H2SO4。
请回答下列问题:
(1)副产品甲是____________,可循环利用的物质是___________________________。
(2)上述生产流程中加入铁屑的目的是_______________________________________。
(3)写出中间产品乙与焦炭、氯气在高温下发生反应的方程式为:________________。
(4)“硫酸法”生产钛排放的废液对水体有哪些污染,请指出主要的两点:
①_________________________________;②_______________________________。
针对其中一项污染,提出处理的方法: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com