
| A、碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O |
| B、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4 NH4++2H2O |
| C、硫代硫酸钠溶液中滴入稀盐酸:S2O32-+2H+=S↓+SO2↑+H2O |
| D、在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
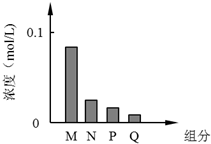 常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )| A、图中N表示HA,P表示OH-,Q表示H+ |
| B、若V=10 mL,则pH=7 |
| C、若V<10 mL,则溶液显酸性 |
| D、若V=10 mL,则:c(M)+c(P)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH4Cl是强酸弱碱盐 | 将NH4Cl溶液蒸干可制备NH4Cl固体 |
| B | Fe3+有强氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | SO2有还原性 | 用SO2可使溴水褪色 |
| D | Cl2有漂白性 | 用Cl2可与石灰乳反应制备含氯消毒剂 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1mol O2和N2混合气体的体积约为22.4L |
| B、1mol气体的体积约为22.4L |
| C、1mol酒精在标准状况下的体积约为22.4L |
| D、22.4L气体所含分子数一定大于11.2L气体所含的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若有固体剩余,则剩余固体一定是Cu |
| B、若有固体剩余,则溶液中一定不含Fe3+和Cu2+ |
| C、若无固体剩余,则溶液中一定有Cu2+和Fe2+ |
| D、若无固体剩余,则溶液中一定有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高铁酸钾与水反应时,水发生还原反应 |
| B、湿法中每生成1molNa2FeO4转移3mol电子 |
| C、干法中每生成1molNa2FeO4转移4mol电子 |
| D、K2FeO4处理水时,不仅能消毒杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、量筒 | B、酸式滴定管 |
| C、碱式滴定管 | D、容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com