
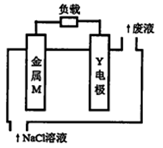
| A.电池工作时,电子沿M→电解液→Y电极流动 |
| B.若M为铝,溶液的pH将不断变大 |
| C.若M为镁,电池总的化学方程式为2Mg+O2=2MgO |
| D.若M为铁,则负极的电极反应式为Fe—2e—=Fe2+ |
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:不详 题型:单选题

| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的K+ 移向ZnSO4溶液 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2+H2O+2e—→Mn2O3+2OH— |
| C.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g[ |
| D.电池工作时,电子由负极通过电解液流向正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
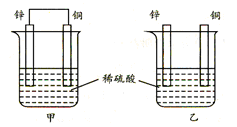
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极, 电极反应:Zn-2e→Zn2+ |
| C.两烧杯中的pH值均增大 |
| D.产生的气泡速率甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
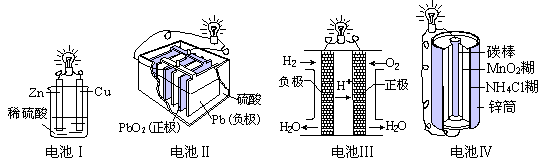
| A.电池Ⅰ中锌是正极 |
| B.电池Ⅱ是一次性电池 |
| C.电池Ⅲ工作时,氢气发生还原反应 |
| D.电池Ⅳ工作时,电子由锌通过导线流向碳棒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.工作时电极b作正极,O2-由电极b流向电极a |
| B.负极的电极反应式为:CO+O2- ―2e-=CO2 |
| C.当传感器中通过2×10-3mol电子时,说明通过的尾气中含有2. 24mL CO |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.负极的电极反应式为:CO+O2-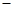 2e-=CO2 2e-=CO2 |
| B.工作时电子由电极a通过传感器流向电极b |
| C.工作时电极b作正极,O2-由电极a流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
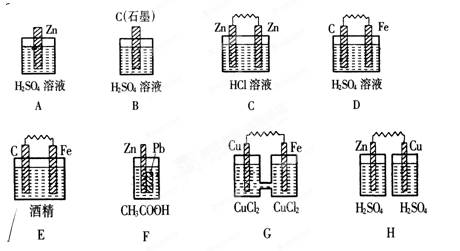
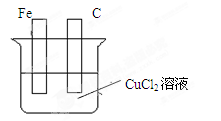
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
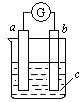
| A.a是锌,b是铜,c是稀硫酸溶液 |
| B.a是铁,b是银,c是硝酸银溶液 |
| C.a是银,b是铁,c是硝酸银溶液 |
| D.a是碳,b是铁,c是氯化铜溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com