
 Fe-2e-=Fe2+ Cu2++2e-=Cu
Fe-2e-=Fe2+ Cu2++2e-=Cu

科目:高中化学 来源:不详 题型:单选题
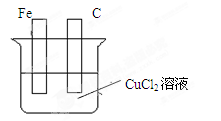
| A.电池工作时,电子沿M→电解液→Y电极流动 |
| B.若M为铝,溶液的pH将不断变大 |
| C.若M为镁,电池总的化学方程式为2Mg+O2=2MgO |
| D.若M为铁,则负极的电极反应式为Fe—2e—=Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是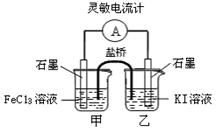
| A.反应开始时,乙中电极反应为2I--2e-= I2 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.平衡时甲中溶入FeCl2固体后,电流计读数为零 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
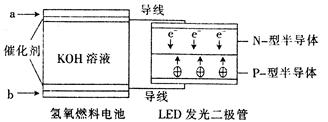
| A.a处通人氧气,b处通人氢气 |
| B.该装置中只涉及两种形式的能量转化 |
| C.电池正极电极反应式为O2+2H2O+4e-﹦4OH- |
| D.P一型半导体连接的是电池负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
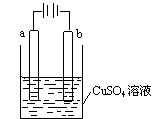
| A.若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-=Cu |
| B.若a和b为铜,通电后a电极有气体产生 |
| C.若a为铜,b为铁,通电后Cu2+向a电极移动 |
| D.若a为粗铜,b为纯铜,通电后b电极质量增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.锌是正极,铜是负极,电流的方向是从锌到铜 |
| B.锌片质量减少,铜片质量增加 |
| C.正极和负极上发生的都是氧化还原反应 |
| D.原电池中的能量变化是:化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com