
2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
MnO4-+ Fe2++ H+= Mn2++ Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中Cu2S的质量分数为 。
(1)1、5、8、1、5、4
(2)0.007
(3)19.6
(4)40%
【解析】
试题分析:(2)设消耗高锰酸钾xmol,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol 5mol
xmol 0.350L×0.1mol/L
所以x=0.007。剩余KMnO4的物质的量为0.007mol。
(3)设(NH4)2Fe(SO4)2?6H2O 的物质的量为ymol,
(NH4)2Fe(SO4)2?6H2O---- Fe2+
1mol 1mol
ymol 0.500L×0.1mol/L
y=0.05,
所以其质量为m=nM=0.05mol×392g/mol=19.6g;
故答案为:19.6g。
(4)设Cu2S的物质的量为mmol,CuS的物质的量为nmol,
8MnO4-+44H++5Cu2S=10Cu2++5SO2+8Mn2++22H2O
8 5
8m/5mol mmol
6MnO4-+28H++5CuS=5Cu2++5SO2+6Mn2++14H2O
6 5
6n/5mol nmol
所以列方程组为:160mg+96ng=2g,8m/5mo+6n/5mol,解得m=0.005,n=0.0125。
所以Cu2S的质量为0.8g,CuS的质量为1.2g,
Cu2S的质量分数为0.8g÷2g×100%=40%,
故答案为:40%
考点:离子方程式的有关计算
点评:本题考查了离子方程式的有关计算,难度较大,易错题是(2),注意铵根离子和(NH4)2Fe(SO4)2的关系式,根据铵根离子计算(NH4)2Fe(SO4)2的质量。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市高三第二次月考化学试卷(解析版) 题型:实验题
(18分)
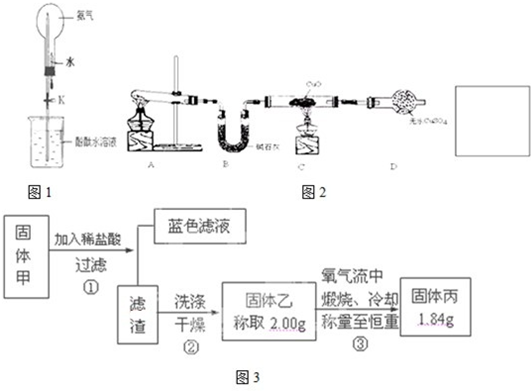
Ⅰ. 氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。
请回答:
(1)实验室制取氨气的化学方程式是 。
(2)① 如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
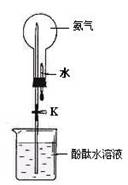
② 氨气使烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
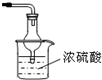
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
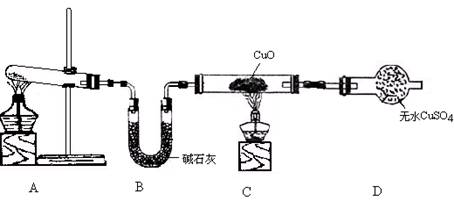
① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③ 整套装置在方框处应添加一种装置后,此实验设计才较完善,请在方框中补画出E装置图(要求注明装置中所加试剂名称)。

Ⅱ. 3.2g Cu与30mL,8mol/L过量HNO3反应,硝酸的还原产物为NO,NO2,反应后溶液中所含H+为a mol,则:①此时溶液中所含的NO3-为 mol。
②所生成的NO在标准状况下体积为 L。(以上结果均用含a的代数式表示)
Ⅲ. 某黑色固体甲可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
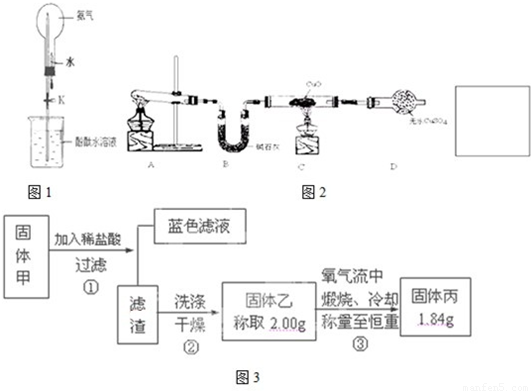
查阅资料知道:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。②硫化铜和硫化亚铜常温下都不溶于稀盐酸。在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
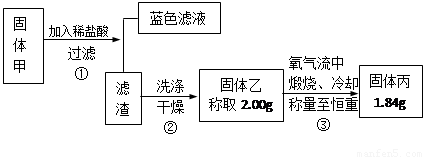
(1)③中在煅烧过程中一定发生的反应的化学方程式为 。
(2)关于固体甲的成分的判断中,下列说法正确的是
A.固体甲中,CuS和Cu2S不能同时存在;
B.固体甲中,CuO和Cu2O至少有一种;
C.固体甲中若没有Cu2O,则一定有Cu2S;
D.固体甲中若存在Cu2O,也可能有Cu2S。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市大港一中高三(上)第二次月考化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com