分析:(1)根据该化合物的蒸气对氢气的相对密度可求得9.2克有机物的物质的量,根据CO
2和H
2O的质量判断9.2克有机物中是否含有O元素,并计算O原子的质量,进而计算C、H、O的物质的量比值,结合相对分子质量可得该有机物的化学式,并书写结构简式;
(2)①将各物质组成通式写成C
xH
yO
z,各物质的(x+
-
)的值相等,则符合题意;
②烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则结构对称,只含一种H;
③不能使溴水褪色,且其一氯代物只有一种,则不含C=C,只有一种H,应为环烃;
(3)根据C、H元素守恒来计算物质的量.
解答:
解:(1)①n(CO
2)=0.4mol,
则2.3g有机物中:n(C)=n(CO
2)=0.4mol,m(C)=0.4mol×12g/mol=4.8g,
n(H
2O)=
=0.6mol,
则9.2g有机物中:n(H)=2n(H
2O)=1.2mol,m(H)=1.2mol×1g/mol=1.2g,
因(1.2g+4.8g)<9.2gg,
所以有机物中还应还用O元素,且m(O)=9.2g-4.8g-1.2g=3.2g,n(O)=
=0.2mol,
则有机物中:n(C):n(H):n(O)=0.4mol:1.2mol:0.2mol=2:6:1,
所以该有机物的最简式为C
2H
6O,又该化合物的蒸气对氢气的相对密度是23,则M=2×23=46,
而C
2H
6O的相对分子质量为46,所以,该有机物的分子式为C
2H
6O,
故答案为:C
2H
6O;
②分子式为C
2H
6O的有机物可以为乙醇或二甲醚,结构简式为:CH
3CH
2OH或CH
3OCH
3,故答案为:C
2H
5OH或CH
3OCH
3;
(2)①烃A的相对分子质量为84,则该烃可能为烯烃或环烷烃,分子式应为C
6H
12,
(1)总物质的量一定,充分燃烧消耗氧气的量不相等,则1molC
6H
12消耗氧气为x+
=9mol,
a.1molC
7H
12O
2消耗氧气为9mol,总物质的量一定,充分燃烧消耗氧气的量相等,故a不选;
b.1molC
6H
14消耗氧气为9.5mol,总物质的量一定,充分燃烧消耗氧气的量不相等,故b选;
c.1molC
6H
14O消耗氧气为9mol,总物质的量一定,充分燃烧消耗氧气的量相等,故c不选;
d.1molC
7H
14O
3消耗氧气为9mol,总物质的量一定,充分燃烧消耗氧气的量相等,故d不选;
故答案为:b;
(2)①烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则结构对称,只含一种H,即含4个甲基,A为

,
故答案为:

(或CH
3)
2C=C(CH
3)
2);
③烃B不能使溴水褪色,且其一氯代物只有一种,则不含C=C,只有一种H,应为环烃,其结构简式为

,故答案为:

;
(3)①CO与H
2按一定比例可合成乙二醇(C
2H
6O
2),根据碳元素和氢元素守恒,则
=
,故答案为:
;
②汽油平均组成用C
mH
n表示,根据碳元素和氢元素守恒,则合成汽油应控制
=
=
,故答案为:
.

 ,
, (或CH3)2C=C(CH3)2);
(或CH3)2C=C(CH3)2); ,故答案为:
,故答案为: ;
;

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案 A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族.
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族.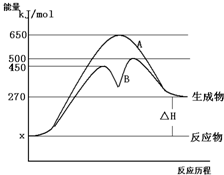 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.