
| A. | 胶粒直径小于1nm | B. | 胶粒作布朗运动 | ||
| C. | 胶粒带正电荷 | D. | 胶粒不受重力作用 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
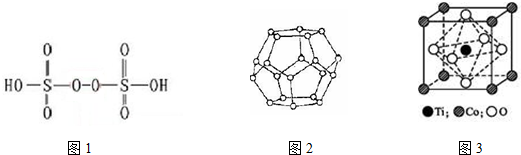
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.25mol•L-1 | B. | 2mol•L-1 | C. | 0.6mol•L-1 | D. | 0.3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应(1)和(2)均为氧化还原反应 | |
| B. | 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 | |
| C. | 高温下,O2的氧化性大于Fe2O3小于Na2CrO4 | |
| D. | 生成1mol的Na2Cr2O7时共转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol/L | B. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | ||
| C. | c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2 c(CO32-) | D. | c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 氯水能使有色花瓣褪色,说明氯水中含有Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com