
| A. | $\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol/L | B. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | ||
| C. | c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2 c(CO32-) | D. | c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-) |
分析 A.常温下,等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,说明滤液呈酸性,溶液中c(OH-)小于纯水中c(OH-);
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.任何电解质溶液中都存在电荷守恒、物料守恒,根据电荷守恒、物料守恒判断;
D.因为析出部分碳酸氢钠,结合物料守恒知滤液中存在c(Cl-)>c(HCO3-),溶液中析出部分碳酸氢根离子、铵根离子水解但程度较小.
解答 解:A.常温下,等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,说明滤液呈酸性,溶液中c(OH-)小于纯水中c(OH-),$\frac{{K}_{w}}{c({H}^{+})}$=c(OH-)<1.0×10-7mol/L,故A正确;
B.任何电解质溶液中都存在物料守恒,碳酸氢铵和NaCl的物质的量相等,虽然析出部分碳B.钠,但仍然存在物料守恒c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确;
C.任何电解质溶液中都存在电荷守恒、物料守恒,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=c(Cl-)+c(OH-)+c(HCO3-)+2 c(CO32-),根据物料守恒得c(Na+)=c(Cl-),则c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2 c(CO32-),因为析出部分钠离子、碳酸氢根离子,所以存在c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2 c(CO32-),故C正确
D.因为析出部分碳酸氢钠,结合物料守恒知滤液中存在c(Cl-)>c(HCO3-),溶液中析出部分碳酸氢根离子、铵根离子水解但程度较小,所以存在c(HCO3-)<c(NH4+),故D错误;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质、析出物质成分是解本题关键,注意溶液中仍然遵循电荷守恒和物料守恒,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、CH3COONa、KCl、NH4NO3、NaHSO4 | |
| B. | Na2CO3、CH3COONa、NaHSO4、NH4NO3、KCl | |
| C. | Na2CO3、KCl、NH4NO3、NaHSO4、CH3COONa | |
| D. | Na2CO3、NH4NO3、CH3COONa、NaHSO4、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
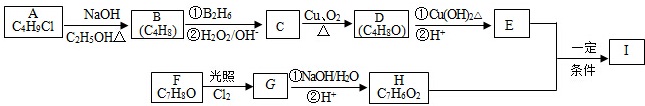
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中NO3-的物质的量为0.7 mol | |
| B. | 硝酸有剩余,铁粉反应完 | |
| C. | 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1:2 | |
| D. | 该硝酸的浓度为12 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中:Na+、AlO2-、SO42-、Cl- | |
| B. | 含大量OH-的溶液中:HCO3-、Na+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 0.1mol/L NaAlO2溶液:H+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯硅可用于制造半导体材料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | 玻璃、水泥、陶瓷、石英的成分中均含有硅酸盐 | |
| D. | Si3N4是一种新型无机非金属材料,可用于制造发动机 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中FeSO4既作氧化剂,又作还原剂 | |
| B. | SO2能使溴水褪色,说明SO2具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为1×6.02×1023 | |
| D. | 该反应生成的气体通入足量BaCl2溶液中,可得到BaSO3和BaSO4两种沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com