
| A. | Na2CO3、CH3COONa、KCl、NH4NO3、NaHSO4 | |
| B. | Na2CO3、CH3COONa、NaHSO4、NH4NO3、KCl | |
| C. | Na2CO3、KCl、NH4NO3、NaHSO4、CH3COONa | |
| D. | Na2CO3、NH4NO3、CH3COONa、NaHSO4、KCl |
分析 相同温度下,等物质的量浓度的这几种溶液中,NaHSO4由于电离显酸性,故pH小于强酸弱碱盐溶液;强酸强碱盐溶液显中性,而强碱弱酸盐溶液呈碱性,据此判断溶液pH大小.
解答 解:首先对物质根据显酸碱性的原因进行分类:
NaHSO4由于完全电离显酸性;NH4NO3由于水解显酸性;KCl不水解,溶液显中性;Na2CO3、CH3COONa均水解显碱性.
由于NaHSO4是强酸盐,故含有的氢离子能完全电离,故溶液显强酸性,而NH4NO3由于水解显酸性,由于水解程度很小,故溶液的酸性较弱,即有pH:NaHSO4<NH4NO3;
KCl不水解,溶液显中性;
Na2CO3、CH3COONa均水解显碱性,但由于对应的酸越弱,则盐越水解,而酸性HCO3-<CH3COOH,故水解能力Na2CO3>CH3COONa,即pH:Na2CO3>CH3COONa.
故物质的量浓度相等的这些溶液pH由大到小的顺序是:Na2CO3>CH3COONa>KCl>NH4NO3>NaHSO4.
故选A.
点评 本题考查了弱电解质的电离及盐类水解,根据“谁强谁显性、谁弱谁水解、强强显中性”确定盐溶液酸碱性,从而确定溶液pH大小,题目难度不大.


科目:高中化学 来源: 题型:解答题
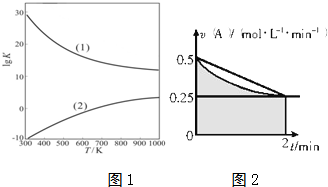
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mLNO | B. | 8mLNO2和4mLO2 | C. | 2mLO2 | D. | 0.25mLO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铁铜原电池(稀硫酸做电解质)放电时的负极反应:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
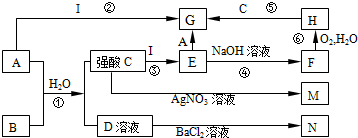
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
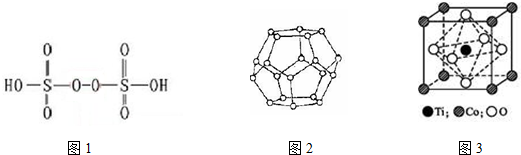
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol/L | B. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | ||
| C. | c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2 c(CO32-) | D. | c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com