
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铁铜原电池(稀硫酸做电解质)放电时的负极反应:Fe-3e-═Fe3+ |
分析 A.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水;
B.酸性高锰酸钾能够将双氧水氧化成氧气;
C.三种的物质的量相等,氢氧化钡优先与HCl发生反应,剩余的氢氧化钡与镁离子反应生成氢氧化镁沉淀;
D.原电池中铁失去2个电子生成亚铁离子.
解答 解:A.向Ba(OH)2溶液中滴加稀硫酸,反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O,故A正确;
B.酸性介质中,KMnO4将H2O2氧化成氧气,反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故B正确;
C.等物质的量的MgCl2、Ba(OH)2 和HC1溶液混合,HCl优先反应,然后剩余的氢氧根离子与镁离子反应,正确的离子方程式为:OH-+H+═H2O、Mg2++2OH-═Mg(OH)2↓,故C错误;
D.铁铜原电池(稀硫酸做电解质)放电时的负极铁失去电子生成亚铁离子,正确的电极反应式为:Fe-2e-=Fe2+,故D错误;
故选CD.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与硝酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 将氨气通入盐酸中:NH3+HCl═NH4++Cl- | |
| D. | 氢氧化钡溶液中滴加稀硫酸:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极反应为:O2+2H2O+4e-═4OH- | |
| B. | 该电池的负极反应为:C8H18+25O2--50e-═8CO2↑+9H2O | |
| C. | 电解质的作用是传递电子 | |
| D. | 电池中阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | NO2 | D. | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、CH3COONa、KCl、NH4NO3、NaHSO4 | |
| B. | Na2CO3、CH3COONa、NaHSO4、NH4NO3、KCl | |
| C. | Na2CO3、KCl、NH4NO3、NaHSO4、CH3COONa | |
| D. | Na2CO3、NH4NO3、CH3COONa、NaHSO4、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | |||||||||||
| C. | 已知:
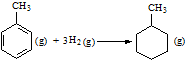 的△H为-384 kJ•mol-1 的△H为-384 kJ•mol-1 | |||||||||||
| D. | 固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Fe2+,可能有Fe3+ | B. | 只有Fe2+,没有Fe3+和Cu2+ | ||
| C. | 可能有Fe3+,可能有Cu2+ | D. | 肯定有Fe2+,可能有Fe3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com