
| A. | 2mLNO | B. | 8mLNO2和4mLO2 | C. | 2mLO2 | D. | 0.25mLO2 |
分析 假定为3molNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成1molNO、2molHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2、2NO+O2=2NO2,从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,据此计算解答.
解答 解:假定为3molNO2,通过饱和碳酸氢钠溶液,首先发生3NO2+H2O=2HNO3+NO,生成1molNO、2molHNO3,再发生反应:HNO3+NaHCO3=NaNO3+CO2↑+H2O,生成2molCO2,从饱和碳酸氢钠溶液出来的气体为1molNO、2molCO2及水蒸气,再通过浓硫酸干燥,出来的气体为1molNO、2molCO2,气体通过过氧化钠,发生反应2CO2+2Na2O2═2Na2CO3+O2,生成1molO2,再发生反应2NO+O2=2NO2,1molNO消耗0.5molO2,生成1molNO2,故从过氧化钠出来的气体最终为0.5molO2、1molNO2,最后用排水法收集,发生反应4NO2+O2+2H2O=4HNO3,1molNO2消耗O2为1mol×$\frac{1}{4}$=0.25mol,故最终剩余的氧气为0.5mol-0.25mol=0.25mol,体积之比等于物质的量之比,故最终收集到的气体是0.25体积的O2,所以24mL的NO2气体,依次通过下列3个分别装有①NaHCO3饱和溶液、②浓H2SO4、③Na2O2的装置后,用排水法把残留气体收集到集气瓶中,0.25×8mL=2mLO2,
故选C.
点评 本题考查混合物的有关计算、根据方程式进行的计算,题目涉及的反应较多、过程复杂,计算量较大,需要学生细心计算,难度中等,清楚发生的反应是解题的关键.


科目:高中化学 来源: 题型:解答题
 根据元素周期表中第四周期元素的相关知识,回答下列问题:
根据元素周期表中第四周期元素的相关知识,回答下列问题: ,CNO-的中心原子的杂化方式为sp.
,CNO-的中心原子的杂化方式为sp.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
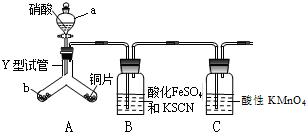 为探究铜与6mol•L-1硝酸反应的气态产物中是否含NO2,进行如下实验.
为探究铜与6mol•L-1硝酸反应的气态产物中是否含NO2,进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ NH4+ SCN- Cl- | B. | Fe3+ Fe2+ Na+ NO3- | ||
| C. | Ba2+ H+ NO3- SO42- | D. | S2- Na+ ClO- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极反应为:O2+2H2O+4e-═4OH- | |
| B. | 该电池的负极反应为:C8H18+25O2--50e-═8CO2↑+9H2O | |
| C. | 电解质的作用是传递电子 | |
| D. | 电池中阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
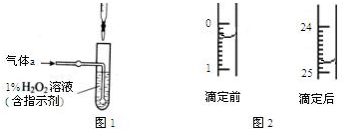
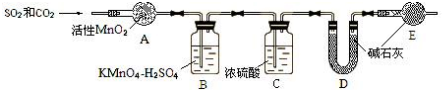
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、CH3COONa、KCl、NH4NO3、NaHSO4 | |
| B. | Na2CO3、CH3COONa、NaHSO4、NH4NO3、KCl | |
| C. | Na2CO3、KCl、NH4NO3、NaHSO4、CH3COONa | |
| D. | Na2CO3、NH4NO3、CH3COONa、NaHSO4、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
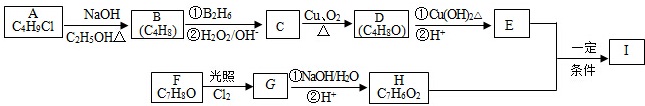
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com