
分析 (1)根据盖斯定律,结合已知热化学方程式,计算求解;根据所以发生反应需要的条件可知需要解决的技术问题有:开发高效光催化剂;将光催化制取的氢从反应体系中有效分离,并与CO2催化转化;
(2)①根据原子利用率表示目标产物的质量与生成物总质量之比来比较;根据平衡常数越大越有利于反应的进行;
②根据温度对平衡常数的影响;
(3)①依据2NH4++3O2═2HNO2+2H2O+2H+;2HNO2+O2═2HNO3,定量关系计算需要氧气的量;
②酸性条件下,甲醇和硝酸根反应生成两种两种无毒气体,这两种气体是二氧化碳和氮气,根据反应物和生成物写出离子方程式;
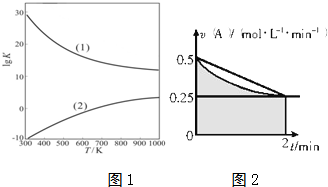
(4)象中阴影部分的面积的含义是指横、纵两坐标变化量的乘积,即浓度变化,此图象中的阴影部分的面积为反应物A浓度的减小值(0~2min);
根据图象可知,阴影部分的面积△c(A)的范围为:0.25 mol?L-1?min-1×2min=0.5mol?L-1<△c(A)<0.25 mol?L-1?min-1×2min+$\frac{1}{2}$×0.25 mol?L-1?min-1×2min=0.75mol?L-1,由此分析解答.
解答 解:(1)光催化制氢:①2H2O(l)═2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与CO2耦合反应:②3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=-137.8kJ•mol-1
根据盖斯定律,把①×3+②×2得方程4H2O(l)+2CO2(g)→2CH3OH(l)+3O2(g)△H=571.5×3+(-137.8)×2=1438.9kJ•mol-1;
则反应:2H2O(l)+CO2(g)═CH3OH(l)+$\frac{3}{2}$O2(g)的△H=718.9KJ/mol
根据所以发生反应需要的条件可知需要解决的技术问题有:开发高效光催化剂;将光催化制取的氢从反应体系中有效分离,并与CO2催化转化,二氧化碳和水供应充足,不用考虑;
故答案为:719.5;ab;
(2)①因原子利用率表示目标产物的质量与生成物总质量之比,反应I的原子利用率为$\frac{30}{32}$×100%=93.7%,反应II的原子利用率为$\frac{30}{48}$×100%=62.5%;平衡常数越大越有利于反应的进行;故答案为:I;II;
②因温度升高,反应I向正向移动,平衡常数增大,反应II逆向移动,平衡常数减小,故答案为:II;
(3)①2NH4++3O2═2HNO2+2H2O+2H+;2HNO2+O2═2HNO3,
2N~2NH4++~4O2~2HNO3,
28 4×32
1g m
m=4.57g
1g铵态氮元素转化为硝态氮元素时需氧的质量为4.57g;
故答案为:4.57;
②酸性条件下,甲醇和硝酸根反应生成氮气、二氧化碳和水,离子方程式为:6NO3-+5CH3OH+6H+═3N2+5CO2+13H2O;
故答案为:6NO3-+5CH3OH+6H+═3N2+5CO2+13H2O;
(4)A.根据以上分析可知,图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值,故A正确;
B.根据分析可知,A在0~2min浓度变化小于0.75mol/L,则该时间段A的反应速率一定小于:$\frac{0.75mol/L}{2min}$=0.375 mol?L-1?min-1,故B正确;
C.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值,不是物质的量的减小值,故C错误;
D.物质的量变化与化学计量数成正比,则2min时,B的物质的量浓度c(B)介于:0.5mol/L×2=1mol/L~0.75mol/L×2=1.5mol/L之间,故D正确;
故选C.
点评 本题考查了热化学方程式和离子方程式定量计算,原电池原理的应用,化学平衡常数影响因素图象分析是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据元素周期表中第四周期元素的相关知识,回答下列问题:
根据元素周期表中第四周期元素的相关知识,回答下列问题: ,CNO-的中心原子的杂化方式为sp.
,CNO-的中心原子的杂化方式为sp.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与硝酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | 将氨气通入盐酸中:NH3+HCl═NH4++Cl- | |
| D. | 氢氧化钡溶液中滴加稀硫酸:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合物为Zn、Al,w不可能是0.1mol | |
| B. | 若混合物为Zn、Fe,w可能大于0.1mol | |
| C. | 若混合物为Fe、Mg,则加入的稀硫酸中溶质质量分数等于9.8% | |
| D. | 若混合物为Cu、Fe,w是0.05mol,则混合物中Fe与Cu的质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
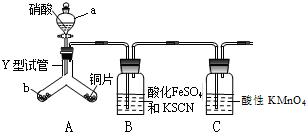 为探究铜与6mol•L-1硝酸反应的气态产物中是否含NO2,进行如下实验.
为探究铜与6mol•L-1硝酸反应的气态产物中是否含NO2,进行如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、CH3COONa、KCl、NH4NO3、NaHSO4 | |
| B. | Na2CO3、CH3COONa、NaHSO4、NH4NO3、KCl | |
| C. | Na2CO3、KCl、NH4NO3、NaHSO4、CH3COONa | |
| D. | Na2CO3、NH4NO3、CH3COONa、NaHSO4、KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com