
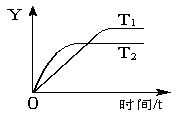
已知反应2SO2(g) + O2(g) 2SO3(g) ΔH=-198kJ·mol-1,向某体积恒定的密闭容器中充入1mol SO2和0.5molO2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化的示意图,下列说法正确的是
2SO3(g) ΔH=-198kJ·mol-1,向某体积恒定的密闭容器中充入1mol SO2和0.5molO2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化的示意图,下列说法正确的是
A.温度T2>T1
B.反应达到平衡后放出99 kJ的热量
C.Y可能是SO2的转化率或SO3的浓度
D.反应达到平衡后容器内气体的密度减小
 |
科目:高中化学 来源: 题型:
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中处处是化学,我们可以用化学的视角去解决、解释生活中的某些问题。下列说法中正确的是
A.生活污水中富含氮、磷的废水可排放到河流、湖泊中,有利于淡水养殖
B.做衣服的棉、麻和丝的成分均为纤维素
C.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2
D.液氯泄漏事故发生时,周边的人应该朝顺风方向或向避风的沟塘低洼处转移
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶有气泡从溶液中冒出
B.实验室用排饱和食盐水法收集氯气
C.合成氨工厂采用增大压强以提高原料的转化率
D.2NO2(g) N2O4(g)的平衡体系中, 加压缩小体积后颜色加深
N2O4(g)的平衡体系中, 加压缩小体积后颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方程式书写正确的是
A.HCO3-的电离方程式:HCO3-+ H2O  H2CO3 + OH-
H2CO3 + OH-
B.NH3·H2O的电离方程式:NH3·H2O NH4+ + OH-
NH4+ + OH-
C.CO32-的水解方程式: CO32- + 2H2O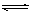 H2CO3 + 2OH-
H2CO3 + 2OH-
D.NH4Cl的水解方程式:NH4+ + H2O===NH3·H2O + H+
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)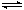 CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:
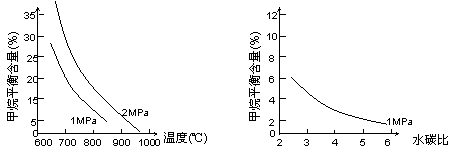 |
图1(水碳比为3) 图2(800℃)
(1)CH4(g)+H2O(g)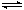 CO(g)+3H2(g)。的△H_______0 (填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
CO(g)+3H2(g)。的△H_______0 (填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是
。
(3)其他条件不变,请在图2中画出压强为2 MPa时,甲烷平衡含量(%)与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列说法不正确的是
A.标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA
B.常温常压下,15g甲基(-CH3)所含的电子数为9NA
C.同温同压下,1LNO和1LO2充分混合体积小于1.5L
D.pH=l的醋酸溶液100mL中氢离子数为0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案
实验设计①:铝镁合金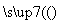 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计②:铝镁合金 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计③:铝镁合金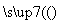 溶液
溶液 过滤,测定得到沉淀的质量
过滤,测定得到沉淀的质量
则能测定出镁的质量分数的是
A.都能 B.都不能 C.①不能,其他都能 D.②③不能,①能
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,甲、乙、丙、丁四种气态烃的分子中所含电子数分别为10、14、16、18,下列关于这四种气态烃的推断正确的是( )
A. 四种气态烃中至少有两种互为同分异构体
B. 可以用酸性高锰酸钾溶液鉴别甲和丁
C. 丙分子中所有原子均在同一平面上
D. 乙和丁属于同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com