
����Ŀ����1����ijNaOH��Һ��Ͷ��һ��Al��������������������������ݣ���������ݵ����ӷ�Ӧ����ʽΪ______��
��2��ʵ���ҳ��û�ԭ��Fe����ˮ������Ӧ��ʵ�����о�Fe�Ļ�ԭ�ԣ���÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪ______
��3��Fe(OH)2�Ʊ�ʱ�����õķ����ǡ����ιܡ�Һ���¡���ʵ�����������ʵ��ʱ�����ڲ������������ɻ���ְ�ɫ����������ɫ����ֱ�����ձ�Ϊ���ɫ������д����ɫ��������ת��Ϊ���ɫ�����Ļ�ѧ��Ӧ����ʽΪ______
��4��ʵ��ʱ�Ʊ�Al(OH)3ʱ�����ÿ��������Σ���Al2(SO4)3�백ˮ��Ӧ�����Ʊ���ij����С����ʵ��ʱ������Al2(SO4)3��Һ�м����˹���NaOH��Һ�����ղ�û���Ƴ���ɫ����Al(OH)3�����С��ͬѧʵ��ʱ�����������ӷ�Ӧ����ʽΪ____��
���𰸡�2Al+2OH-+2H2O=2AlO2-+3H2��3Fe+4H2O(g)![]() Fe3O4+4H24Fe(OH)2+O2+2H2O=4Fe(OH)3Al3++4OH-=AlO2-+2H2O
Fe3O4+4H24Fe(OH)2+O2+2H2O=4Fe(OH)3Al3++4OH-=AlO2-+2H2O
����������1������Ͷ��NaOH��Һ�У�������������������Ϊ������������Ĥ������Ĥ��Ӧ��Al��NaOH��Һ��Ӧ�����������ʴ�Ϊ��2Al+2OH-+2H2O=2AlO2-+3H2����
��2������ˮ�����ڸ��£�����ȣ��·�Ӧ����Fe3O4��H2���ʴ�Ϊ��3Fe+4H2O(g)![]() Fe3O4+4H2��
Fe3O4+4H2��
��3����ɫFe(OH)2�������ױ���������Ϊ���ɫFe(OH)3�������ʴ�Ϊ��4Fe(OH)2+O2+2H2O=4Fe(OH)3��
��4��ʵ������ȡAl(OH)3ͨ����������Һ�백ˮ��Ӧ������������������Һ����ΪAl(OH)3�������ԣ�����ǿ����Һ��Ӧ���ʴ�Ϊ��Al3++4OH-=AlO2-+2H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ϡ�������ij��ʯ�����Һ�У����˺��д��������⣬����������NH![]() ��Fe3����AsO
��Fe3����AsO![]() ��Cl����Ϊ��ȥ�������ӣ����ֲ����������£�
��Cl����Ϊ��ȥ�������ӣ����ֲ����������£�
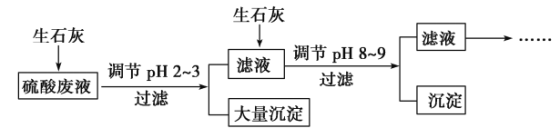
��ش����⣺
(1)��ϡ�������ij��ʯ�����Һ�У������Ũ��Ϊ4.9 g��L��1�������Һ�е�pHԼΪ_____________________________��
(2)NH![]() ����ϡ�������ij��ʯ�����Һ����(NH4)2SO4��NH4Cl��ʽ���ڡ�����һ��(NH4)2SO4��Һ��һ��NH4Cl��Һ��(NH4)2SO4��Һ��c(NH
����ϡ�������ij��ʯ�����Һ����(NH4)2SO4��NH4Cl��ʽ���ڡ�����һ��(NH4)2SO4��Һ��һ��NH4Cl��Һ��(NH4)2SO4��Һ��c(NH![]() )ǡ����NH4Cl��Һ��c(NH
)ǡ����NH4Cl��Һ��c(NH![]() )��2������c[(NH4)2SO4]__________c(NH4Cl)(���������������)��
)��2������c[(NH4)2SO4]__________c(NH4Cl)(���������������)��
(3)�������Һ��Ͷ����ʯ��(������Һ�¶ȵı仯)����Һ��![]() __________(�������С�����䡱)��
__________(�������С�����䡱)��
(4)Ͷ����ʯ�ҵ���pH��2��3ʱ������������Ҫ�ɷ�ΪCaSO4��2H2O[��������Fe(OH)3]���ᴿCaSO4��2H2O����Ҫ�������裺������м������________����ַ�Ӧ���ˡ�ϴ�ӡ�__________________________��
(5)25 �棬H3AsO4���볣��ΪK1��5.6��10��3��K2��1.7��10��7��K3��4.0��10��12������Һ��pH���ڵ�8��9ʱ��������Ҫ�ɷ�ΪCa3(AsO4)2��
��pH���ڵ�8����Ca3(AsO4)2�ſ�ʼ������ԭ����_____________________��
��Na3AsO4��һ��ˮ���ƽ�ⳣ����ֵΪ___________________��
����֪��AsO![]() ��2I����2H��===AsO
��2I����2H��===AsO![]() ��I2��H2O��SO2��I2��2H2O===SO
��I2��H2O��SO2��I2��2H2O===SO![]() ��2I����4H��������������Ӧ�л�ԭ����ǿ������__________��
��2I����4H��������������Ӧ�л�ԭ����ǿ������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ��۲���ȷ���ǣ� ��
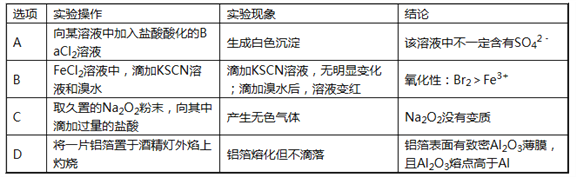
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ������ȷ����ǣ� ��
�� | �� | �� | ���������� | |
A | ���� | ���� | �ռ� | �������� |
B | ������ | ���� | ���� | ����ͭ |
C | �ռ� | ���� | ���� | �������� |
D | �������� | ̼�� | С�մ� | ˮ |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2016���¿α�ȫ����]��ѧ�����������Ź㷺��Ӧ�ã����ж�Ӧ��ϵ�������
ѡ�� | ��ѧ���� | ʵ��Ӧ�� |
A | Al2(SO4)3��С�մ�Ӧ | ��ĭ�������� |
B | ����ͭ������ǿ | FeCl3��ʴCu����ӡˢ��·�� |
C | �������ξ��������� | Ư��Ư��֯�� |
D | HF��SiO2��Ӧ | ������ڲ��������Ͽ�ʴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����ʵ�鱨�����г������������к�������( )
A����10mL��Ͳ��ȡ 7.13 mLϡ����
B����������ƽ���� 25.20gNaCl
C���ù㷺pH��ֽ���ij��Һ��pHΪ 2.3
D����25 mL�ζ������к͵ζ�ʱ����ȥijŨ�ȵļ���Һ 21.70 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʳƷ���Ӽ�����
A. NaOH B. ��ҵNaCl C. ��ȩˮ��Һ D. ���ܲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����ォ���ǵ�����ˮ�Ƴ�����ˮ����õķ����ǣ� ��
A.����
B.��ȡ
C.����
D.�ȹ��˺�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ�ء�Xԭ�������������Ǻ�����Ӳ�����3����Y�������������۵Ĵ�����Ϊ6��Z�ڵؿ��еĺ�������������Y��Z��Wͬ���ڣ�W�ij������ϼ�Ϊ+3���ش��������⣺
(1)YԪ�ؼ����ӵĽṹʾ��ͼΪ ��
(2) Y��Z��ȣ��ǽ�����ǿ���� ��дԪ�ط��ţ���������ʵ��֤����һ���۵��� ��
A��������Y�ĵ��ʳ���̬����Z�ĵ��ʳʹ�̬��
B����̬�⻯����ȶ���Y��Zǿ��
C��Y��Z�γɵĻ������У�Z�Ļ��ϼ۳����ۡ�
(3)Z��Ԫ�����ڱ��е�λ���� ��Z�������������Zͬ����ĵ���A�ܷ����û���Ӧ�������Ӧ�ڹ�ҵ���ǻ��Z��һ����Ҫ��Ӧ��д���ò���Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ�������Ŀ ��
(4)��WY3��Һ�м���������NaOH��Һ����Ӧ�����ӷ���ʽΪ ��
(5)ZX2�д��ڵĻ�ѧ��Ϊ (�������Ӽ����������ۼ���)��������;�ܹ㷺����д������һ����; ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com