
【题目】下列有关原子结构和元素周期律的表述正确的是( )
A.原子序数为15的元素的最高化合价为+3
B.ⅦA族元素是同周期中非金属性最强的元素
C.第二周期ⅣA族元素的原子核电荷数和中子数一定为6
D.I A族元素的金属性一定比ⅡA族元素的金属性强
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:________。
(2)用盐酸酸浸时,为使酸浸速率加快,可采取的一种措施是:____________________,发生反应的离子方程式为:____________________________________。
(3)流程中通过过滤得到草酸氧化钛钡晶体,过滤操作中使用的玻璃仪器有:______________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:___________________________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol·L-1,则c(CO32-)在浸出液中的最大浓度为:_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是

A.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
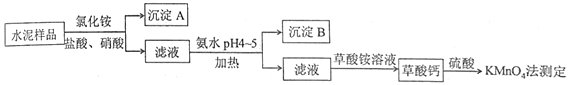
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: ![]() +H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
+H++H2C2O4→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有两种溶质 NaCl 和 H2SO4,它们的物质的量之比为 3∶1。用石墨作电极电 解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是
A. 阴极自始至终只逸出 H2 B. 阳极先逸出 Cl2,后逸出 O2
C. 溶液 pH 不断增大,最后为 7 D. 电解最后阶段为电解水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在绿色化学工艺中,理想状态是反应物原子全部转化为欲制的产物,即原子利用率为![]() 。以下反应最符合绿色化学“原子经济”要求的是( )
。以下反应最符合绿色化学“原子经济”要求的是( )
A. 乙烯聚合为聚乙烯高分子材料B. 甲烷与氯气制备一氯甲烷
C. 以铜和浓硫酸为原料生产硫酸铜D. 用二氧化硅制备高纯硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下,分别测得反应2SO2+O2![]() 2SO3的速率如下,其中最快的是( )
2SO3的速率如下,其中最快的是( )
A. v(SO2)=4 mol/(L·min) B. v(O2)=2 mol/(L·min)
C. v(SO2)=0.1 mol/(L·min) D. v(SO2)=0.1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
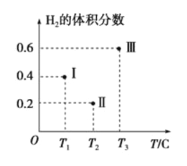
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2SO3·CuSO3·2H2O是一种深红色固体(以下用M表示)。某学习小组拟测定胆矾样品的纯度,并以其为原料制备M。
已知:①M不溶于水和乙醇,100℃时发生分解反应;
②M可由胆矾和SO2为原料制备,反应原理为3Cu2++6H2O+3SO2![]() Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
I.测定胆矾样品的纯度。
(1)取w g胆矾样品溶于蒸馏水配制成250mL溶液,从中取25.00mL于锥形瓶中,加入指示剂,用c mol·L-1EDTA(简写成Na4Y)标准溶液滴定至终点(滴定原理:Cu2++Y4-====CuY2-),测得消耗了V mL EDTA标准溶液。则该胆矾样品的纯度为____________%(用含c、V、w的代数式表示)。如果滴定管装液前没有用EDTA标准溶液润洗,测得的结果会_________ (填“偏高”“偏低”或“无影响”)。
Ⅱ.制备M。实验装置如下图所示:

(2)实验室用70%硫酸与亚硫酸钠粉末在常温下制备SO2。上图A处的气体发生装置可从下图装置中选择,最合适的是________(填字母)。

(3)装置D中的试剂是____________。装置B中水浴加热的优点是____________________。
(4)实验完毕冷却至室温后,从锥形瓶中分离产品的操作包括:__________、水洗、乙醇洗、常温干燥,得产品Cu2SO3·CuSO3·2H2O。检验产品已水洗完全的操作是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com