
【题目】下列各组粒子中,具有相同核外电子排布的是( )
A.Mg2+、Al3+B.Ca2+、AlC.O2-、S2-D.F-、Ar
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。

实验一:制备NaClO溶液(实验装置如图1所示)
(1)锥形瓶中发生反应的离子方程式是________________________________________________。
实验二:制取水合肼.(实验装置如图2所示)
已知水合肼具有还原性,被氧化生成氮气。
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(2)分液漏斗中的溶液是______(填标号).
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________________________________________________。
实验三:测定馏分中水合肼的质量分数。采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液。
b.移取25.00mL溶液于锥形瓶中,加入10mL水,摇匀。
c.用0.2000 mol·L-1的I2溶液滴定,至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右,记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为:_______________________;
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_______________。
(5)滴定时,碘的标准溶液盛放在___________(填“酸式”或“碱式”)滴定管中;若三次滴定消耗碘的标准溶液的平均体积为18.00mL,则馏分中水合肼(N2H4·H2O)的质量分数为____________________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①泥浆中泥沙是溶质,水是溶剂
②医用酒精中,水是溶剂,酒精是溶质
③凡是分散质能通过半透膜的分散系即属于胶体
④通过丁达尔现象可以鉴别胶体和溶液.
A.①②③④
B.②④
C.②③
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种常见试剂,在实验室、工业生产上有广泛用途

Ⅰ.实验室用H2O2快速制氧,其分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如甲乙丙丁四图所示:
(1)下列说法正确的是:________(填字母序号)
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
(2)催化剂Mn2+在反应中,改变了____________________(填字母序号)
A.反应速率 B.反应限度C.反应焓变 D.反应路径
E.反应活化能 F.活化分子百分数
Ⅱ. H2O2在工业上作为Fenton法主要试剂,常用于处理含难降解有机物的工业废水。在调节好pH(溶液的酸碱性)和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验,并将实验结果绘制时间-p-CP浓度图如下。

(3)电中性的羟基自由基的电子式为:______________
(4)请完成以下实验设计表(表中不要留空格)。
实验 编号 | 实验目的 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | _________ | ______ | _______ | _________ |
③ | __________________ | <>298 | 10 | 6.0 | 0.30 |
(5)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:v(p-CP)=_____________
(6)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据实验结果,给出一种迅速停止反应的方法:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图给定的仪器组成一套实验装置(各仪器只允许用一次),在室温、 1.01×105 Pa的条件下测定镁的相对原子质量。
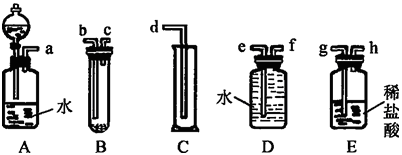
请回答下列问题:
(1)假设气流方向为左→右,则各仪器的接口连接的先后顺序为 (用小写字母填写)。
(2)连接好仪器后,要进行的操作有以下几步:
①待仪器B中的物质恢复至室温时,测量量筒 C中水的体积(假定将测定的体积换算成标准状况下为 V mL);
②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m g,并将其放入试管B中);
③检查各装置的气密性;
④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。
(3)根据实验数据可计算出镁的相对原子质量,其数学表达式为 。
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(5)若未擦净镁条表面的氧化膜就进行实验,这将会使所测镁的相对原子质量数据 (填“偏大”“偏小”或“无影响”)。
(6)实验中需要用480 mL 1 mol/L的盐酸,配制过程中用于定容的玻璃仪器的规格和名称是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.1mol/L醋酸溶液中含有醋酸分子的数目为0.1NA
B. 25℃时,1LpH=12的Na2CO3溶液中含有Na+的数目为0.2NA
C. 常温下,20LpH=12的Na2CO3溶液中含有OH-数目为0.2NA
D. 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭器中发生可逆反应:A(g)+2B(g) ![]() 2C(g) ΔH=+Q(Q>0),条件变化时,影响平衡移动的关系如图所示。下列说法不正确的是( )
2C(g) ΔH=+Q(Q>0),条件变化时,影响平衡移动的关系如图所示。下列说法不正确的是( )
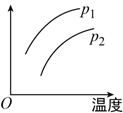
A. p1<p2,纵坐标指A的质量分数
B. p1>p2,纵坐标指C的质量分数
C. p1>p2,纵坐标指混合气体的平衡摩尔质量
D. p1>p2,纵坐标指A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢是一种有臭鸡蛋气味的剧毒气体,在生产、生活及科研中均有重要应用。
(1)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离出H2,发生的反应为2H2S(g)![]() 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
已知:①H2S(g)![]() H2(8)+S(g)△H1
H2(8)+S(g)△H1
②2S(g)![]() S2(g)△H2
S2(g)△H2
则△H=________(用含△H1、△H2的式子表示)。
(2)在容积2 L的恒容密闭容器中,控制不同温度进行H2S分解:2H2S(g)![]() 2H2(g)+S2(g)。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图1所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g)+S2(g)。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图1所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。

①反应2H2S (g)![]() 2H2(g)+S2(g)是放热还是吸热,判断并说理由________。
2H2(g)+S2(g)是放热还是吸热,判断并说理由________。
②随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是________ 。
③在985℃时,该反应经过5 s达到平衡,则该反应的平衡常数为________。在图2中画出985℃时,0~6s 体系中S2(g)浓度随时间的变化曲线。___________________


(3)工业上常用NaOH溶液吸收H2S废气,吸收后所得溶液进行电解(装置如图3所示),在阳极区可生成Sx2-,写出生成Sx2-离子的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是
A. pH=1.2时,c(H2A)=c(HA-)
B. lg[K2(H2A)]=-4.2
C. pH =2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com