
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。

实验一:制备NaClO溶液(实验装置如图1所示)
(1)锥形瓶中发生反应的离子方程式是________________________________________________。
实验二:制取水合肼.(实验装置如图2所示)
已知水合肼具有还原性,被氧化生成氮气。
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(2)分液漏斗中的溶液是______(填标号).
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________________________________________________。
实验三:测定馏分中水合肼的质量分数。采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液。
b.移取25.00mL溶液于锥形瓶中,加入10mL水,摇匀。
c.用0.2000 mol·L-1的I2溶液滴定,至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右,记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为:_______________________;
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是_______________。
(5)滴定时,碘的标准溶液盛放在___________(填“酸式”或“碱式”)滴定管中;若三次滴定消耗碘的标准溶液的平均体积为18.00mL,则馏分中水合肼(N2H4·H2O)的质量分数为____________________(保留三位有效数字)。
【答案】 Cl2+2OH-=ClO-+Cl-+H2O B 如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化 N2H4H2O +2I2=N2↑+4HI+H2O 生成的HI与NaHCO3反应 酸式 18.0%
【解析】(1)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH﹣=ClO﹣+Cl﹣+H2O;
故答案为:Cl2+2OH﹣=ClO﹣+Cl﹣+H2O;
(2)依据制取水合肼(N2H4H2O)的原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl,可知,要将CO(NH2)2溶液与NaOH和NaClO混合溶液加在一起发生反应。根据题中的已知信息,“水合肼具有还原性,被氧化生成氮气。”可知,水合肼能被强氧化性的NaClO氧化成氮气,所以NaOH和NaClO混合溶液一定不能过量。则要将NaOH和NaClO混合溶液滴入CO(NH2)2溶液中,即分液漏斗中装NaOH和NaClO混合溶液。
故答案为:B;如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
(3)水合肼与碘溶液反应发生氧化还原反应,生成N2、HI和H2O,反应的化学方程式为:N2H4H2O+2I2=N2↑+4HI+H2O;
故答案为:N2H4H2O+2I2=N2↑+4HI+H2O;
(4)NaHCO3能控制溶液的pH在6.5左右,是因为生成的HI与NaHCO3 反应;
(5)碘单质具有氧化性,应选择酸式滴定管;结合反应定量关系计算水合肼(N2H4H2O)的质量分数,
N2H4H2O+2I2=N2↑+4HI+H2O;
1 2
n 0.2000mol/L×0.018L
n=0.0018mol
250ml溶液中含有的物质的量=0.0018mol×![]() =0.018mol
=0.018mol
水合肼(N2H4H2O)的质量分数=![]()
故答案为:酸式,18.0%


科目:高中化学 来源: 题型:
【题目】阅读题目,回答问题。
(1)已知: P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1, P4(s)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。请回答:PCl3(g)和氯气反应生成PCl5(g)的热化学方程式为________________________________,Cl—Cl 键的键能为_________________________。
(2)离子液体是一种室温熔融盐非水体系。由有机阳离子、Al2Cl7-利AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。则钢制品应接电源的__________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_________________________。
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图
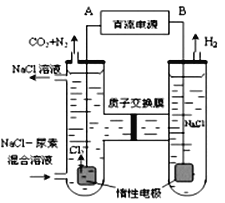
①电源的负极为_____________(填“A”或“B”)。
②阳极室中发生的反应为_____________________,______________________。
③电解结束后,阴极室溶液的pH 与电解前相比将____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键的下列说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在单个水分子、水蒸气、液态水、冰中都存在氢键
C. 分子间能形成氢键使物质的熔沸点升高
D. HF的热稳定性很强,是因为其分子间能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于配合物的是( )
A. [Cu(H2O)4]SO4·H2O B. [Ag(NH3)2]OH
C. KAl(SO4)2·12H2O D. Na[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )
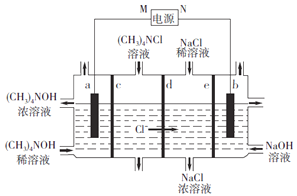
A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。某化学小组用PCl3氧化法制备POCl3的装置如下图所示。已知:POCl3的沸点是105.1℃,PCl3 的沸点是65.5℃;二者遇潮湿空气都易生成酸雾。

(1)仪器a的名称为_______________。
(2)装置A是氧气的发生装置,试写出A中发生反应的化学方程式:___________________。
(3)装置B的作用是______________________________________________________________。
(4)装置C中反应温度应控制在60~65℃,原因是_____________________________________。
(5)通过佛尔哈德法可以测定POCl3产品中氯元素的质量分数,实验步骤如下:
Ⅰ.取1.5000g 产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸调至酸性。
Ⅱ.向锥形瓶中加入3.2000mol·L-1的AgNO3溶液10.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2.00mL硝基苯,用力摇动,使沉淀表面被硝基苯覆盖。
Ⅳ.加入指示剂,用0.2000mol·L-1NH4SCN标准溶液滴定过量Ag+至终点,消耗10.00mLNH4SCN溶液。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2.0×10-12。
①滴定选用的指示剂是________(填代号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是_____________________________,若无此操作所测氯元素的质量分数将会________(填“偏大”、“偏小” 或“不变”)。
③产品中氯元素的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com