
| A. | 有单质参加或有单质生成的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应属于氧化还原反应,因为单质中元素化合价必然发生变化 | |
| C. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| D. | 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
分析 A.同素异形体之间的转化为非氧化还原反应;
B.化合物分解生成单质,一定存在化合价的变化;
C.只要存在化合价的变化,一定属于氧化还原反应,与是否有单质参加无关;
D.氧化还原反应可以发生在同种元素之间.
解答 解:A.同素异形体之间的转化有单质生成或有单质参加,但无化合价变化,不属于氧化还原反应,故A错误;
B.化合物分解生成单质,一定存在化合价的变化,一定属于氧化还原反应,故B正确;
C.只要存在化合价的变化,一定属于氧化还原反应,与是否有单质参加无关,如过氧化氢与二氧化硫反应可生成硫酸,为氧化还原反应,但没有单质参加,故C错误;
D.氧化还原反应可以发生在同种元素之间,如在Cl2+H2O=HCl+HClO反应中,只有Cl元素化合价发生变化,故D错误.
故选B.
点评 本题考查氧化还原反应,侧重基本概念的考查,明确反应中氧化还原反应中氧化剂、还原剂与化合价的变化及反应的特征即可解答,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4中所含分子数为NA | |
| B. | 标准状况下,18g水所含原子数为NA | |
| C. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| D. | 常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=3.0mol•L-1•min-1 | B. | v(B)=0.280 mol•L-1•s-1 | ||
| C. | v(C)=4.8mol•L-1•min-1 | D. | v(D)=0.20mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
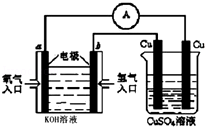 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A的结构式如图,据你所学知识,判断A属于( )
A的结构式如图,据你所学知识,判断A属于( )| A. | 酸类 | B. | 醚类 | C. | 醛类 | D. | 酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{6}$ | B. | $\frac{1}{4}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气加CuSO4加快反应速率 | |
| B. | 明矾在生产中常作净水剂 | |
| C. | NaHCO3与Al2(SO4)3混合作泡沫灭火剂 | |
| D. | 热的纯碱溶液去油污效果更好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com