
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
| ||


科目:高中化学 来源: 题型:
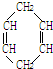 可简写为
可简写为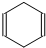 .现有某化合物W的分子结构可表示为
.现有某化合物W的分子结构可表示为 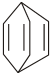 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下NaB溶液的pH=8,c(Na+)-c(B-)=1×10-2 mol/L |
| B、Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、KHSO3溶液呈酸性,c(K+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) |
| D、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O等体积混合后溶液呈碱性:c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-二甲基-2-溴丁烷发生消去反应后的生成物不存在同分异构体 |
| B、在CH3-CH=CH-C≡C-CF3分子中,6个碳原子一定不在同一平面上 |
| C、由2-氯丙烷制取1,2-丙二醇时,需要经过取代→消去→加成三步反应完成 |
| D、将铜丝在酒精灯火焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4 |
| B、[H+]=1×10-3 mol?L-1 |
| C、[OH-]=1×10-11 mol?L-1 |
| D、[H+]?[OH-]=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲区呈现红色 |
| B、乙区产生Zn2+ |
| C、丙区发生的电极反应式:Cu-2e-=Cu2+ |
| D、丁区呈现蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com