
 下表为长式周期表的一部分,其中的序号代表对应的元素.
下表为长式周期表的一部分,其中的序号代表对应的元素.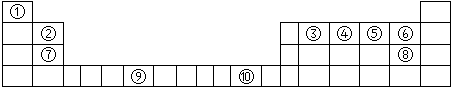
| 2 |
| 2 |
| m |
| V |
| 1 |
| 2 |
| 1 |
| 8 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
16
|
| ||
| 8d3 |
| ||
| 8d3 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8L 0.4mol/L的NaOH溶液 |
| B、0.2L0.15mol/L的Na3PO4 |
| C、1L0.3mol/L的NaCl溶液 |
| D、0.1L 0.5mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.8g熔融的KHSO4中含有0.05NA个阴离子 |
| B、1.0L 1mol/L的NaOH水溶液中含有的氧原子数目为2 NA |
| C、25℃时,pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 |
| D、5.6g铁与一定量稀硝酸完全反应,电子转移数目一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1CH3COONa溶液:H+、Al3+、Cl-、NO3- |
| B、含有NaNO3的溶液:H+、Fe2+、SO42-、Cl- |
| C、能使甲基橙变红的溶液:K+、Na+、NO3-、Cl- |
| D、由水电离产生的c(H+)=10-12 mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3通入CH3COOH溶液中 |
| B、CO2通入澄清石灰水中 |
| C、CO2通入NaOH溶液中 |
| D、NH3通入盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水分别与盐酸、醋酸反应 |
| B、硫酸铜分别与BaCl2、Ba(OH)2反应 |
| C、石灰石分别与盐酸、硝酸反应 |
| D、稀硫酸分别与Na2CO3、NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com