
【题目】某学生进行淀粉的水解实验,操作如下:
(1)取少量淀粉溶液,加入3~5滴稀硫酸,加热几分钟。淀粉水解反应的化学方程式为________________
(2)取少量冷却后的水解液,向其中加入银氨溶液,水浴加热无银镜产生。他由此认为:水解产物中没有葡萄糖。他的结论是否正确?________________,理由是________________
(3)用5t含淀粉80%的粮食,可以制得葡萄糖的质量为______。(假设淀粉的转化率为81%)
【答案】(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖) 不正确 没有向水解液中加入NaOH溶液调节pH至碱性 3.6t
nC6H12O6(葡萄糖) 不正确 没有向水解液中加入NaOH溶液调节pH至碱性 3.6t
【解析】
(1)淀粉在酸性条件下,水解生成葡萄糖,反应的化学方程式为(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖),故本题答案为:(C6H10O5)n(淀粉)+nH2O
nC6H12O6(葡萄糖),故本题答案为:(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖);
nC6H12O6(葡萄糖);
(2)银镜反应需要在碱性条件下进行,滴加银氨溶液之前,要滴加氢氧化钠调节pH至碱性,所以该结论不正确,故本题答案为:不正确;没有向水解液中加入NaOH溶液调节pH至碱性;
(3)淀粉在一定条件下水解生成葡萄糖,反应方程式为(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖),淀粉的质量=5t×80%=4t,淀粉的转化率为81%,设葡萄糖的质量为x,
nC6H12O6(葡萄糖),淀粉的质量=5t×80%=4t,淀粉的转化率为81%,设葡萄糖的质量为x,
(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
162n 180n
4t×81% x
![]()
x=3.6t,
故本题答案为:3.6t.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】在0.4 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
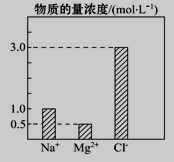
(1)该混合液中,NaCl的物质的量为________mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为_________mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为___________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据事实,写出298K时下列反应的热化学方程式:
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为__。
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3kJ热量。___。
(3)家用液化气中主要成分之一是丁烷。当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧反应的热化学方程式___。
(4)1molHgO(s)分解为液态汞和氧气,吸热90.7kJ。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收废水中苯酚的过程如图所示。下列分析错误的是

A. 操作I中苯作萃取剂
B. 苯酚钠在苯中的溶解度比在水中的大
C. 通过操作II苯可循环使用
D. 三步操作均需要分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物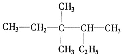 的名称为_____________;
的名称为_____________;
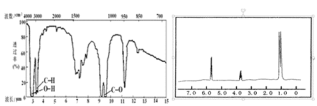
(2)已知某有机物的分子式为C3H8O,红外光谱和核磁共振氢谱如图,氢谱三个峰的面积之比分别为1∶1∶6,写出其结构简式___;
(3)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①烃A的分子式为__________;
②若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为______;
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为_______,_____,_____(任写3种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用菱镁矿(主要含MgCO3,FeCO3杂质)制取碱式氯化镁[Mg(OH)Cl]的流程。已知:MgO用于调节沉淀池中溶液的pH值。
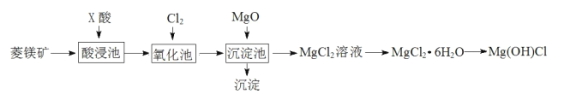
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Mg2+ | 8.8 | 11.4 |
下列说法不正确的是( )
A.酸浸池中加入的![]() 酸可以是硫酸
酸可以是硫酸
B.加入MgO后的沉淀一定含有Fe(OH)3
C.氧化池中通入氯气的目的是将Fe2+氧化为Fe3+
D.制得碱式氯化镁的方程式为:MgCl2·6H2O![]() Mg(OH)Cl+HCl↑+5H2O↑
Mg(OH)Cl+HCl↑+5H2O↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用下列实验装置制备并研究SO2的性质,请按要求回答下列问题(夹持装置和A中加热装置已省略)。

操作步骤择要如下:
Ⅰ.打开活塞K,先通入一段时间N2,再关闭活塞K,加热A一段时间;
Ⅱ.A中不再产生气体后,停止加热,打开活塞K,缓慢通入氮气直至A装置冷却。
(1)装有Cu粒的仪器名称是________。
(2)实验室可用亚硫酸钠与浓硫酸制取SO2,该化学方程式是_______。
(3)下列说法正确的是____
A. 装置应在加入药品后检验装置气密性
B. 操作Ⅱ中继续通入氮气可以避免溶液出现倒吸
C. 装置A中的浓硫酸体现出了强氧化性、酸性
D. 装置B和装置D中都出现了褪色,是因为SO2有漂白性
(4)装置C中出现白色浑浊,请用离子方程式解释原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十亿年来,地球上的物质不断的变化,大气的成分也发生了很大的变化.下表是原始大气和目前空气的主要成分,用下表涉及的分子回答下列问题。
原始大气的主要成分 | CH4、NH3、CO、CO2等 |
目前空气的主要成分 | N2、O2、CO2、水蒸气、稀有气体(He、Ne等) |
(1)含有非极性共价键的分子是______(填化学式)
(2)含有极性共价键的非极性分子是______(填化学式)
(3)H2O中心原子的杂化方式及分子构型为______
(4)图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物。其中代表CH4的是______(填字母序号)
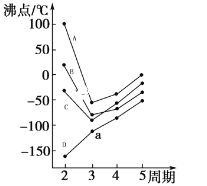
(5)根据NH3H2ONH4++OH-,用氢键表示式写出氨分子和水分子之间最主要存在的氢键形式______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com