
【题目】在通风橱中进行下列实验:
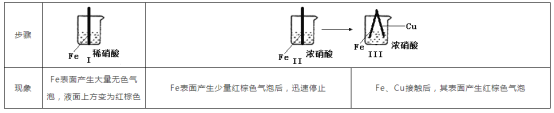
下列说法中不正确的是
A. Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 过量铁与稀硝酸反应生成亚铁盐
D. 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】配制250 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
A. 溶解后溶液尚未冷却就转移至容量瓶中
B. 转移溶液后未洗涤烧杯和玻璃棒
C. 在容量瓶中定容时仰视刻度线
D. 倒转摇匀后,发现液面低于刻度,再补水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向4L恒容密闭容器中充入2 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是 ( )
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4 mol PCl3、4 mol Cl2,达到平衡时,则此反应的化学平衡常数为0.025
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用空气吹出法提取溴的部分流程如下:

下列说法错误的是()
A. ②中可以采用纯碱溶液,发生的反应是:3Br2+6CO32-+3H2O =5Br-+BrO3-+6HCO3-
B. 第③步,需加入氧化性酸,才能将Br-氧化为Br2
C. B溶液颜色要比A溶液深
D. 第④步,采用的是蒸馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列计算结果正确是
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2=3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的1/8
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为(1/22.4)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_______________________________________________________。
(2)B为0.1 mol·L-1Na2CO3溶液,该溶液显碱性的原因为:______________。(写离子方程式)
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________以抑制其水解。把B和C溶液混合,发生反应的离子方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列状态的物质①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖
其中属于电解质的是___________ ,属于强电解质的是_____________。能导电的是___________。
Ⅱ.胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入___________溶液,继续煮沸至____________,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为______________________________________________。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做_______________。
③区分胶体和溶液常用的方法叫做__________。
Ⅲ.①FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为_________________________。
②有学生利用FeCl3溶液制取FeCl36H2O晶体主要操作包括:滴入过量盐酸,______、冷却结晶、过滤。过滤操作除了漏斗、烧杯还需要什么玻璃仪器________________。
③高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硫酸铜溶液中加入一小块金属钠后,观察到的现象有
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜
⑦小球在溶液中沉浮 ⑧小球在液面上游动、逐渐变小,直至消失
A. ①②③④⑤⑥ B. ①②③④⑤⑧ C. ①②③⑥⑧ D. ②⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com