
【题目】下列计算结果正确是
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2=3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的1/8
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为(1/22.4)mol/L
【答案】D
【解析】
A、浓盐酸与二氧化锰反应生成氯气,稀盐酸与二氧化锰不反应;
B、依据还原剂发生氧化反应得到氧化产物,氧化剂发生还原反应得到还原产物计算即可;
C、将NO2和O2等体积混合充满一试管,倒置于水槽中,发生![]() ,根据反应方程式计算剩余气体的体积;
,根据反应方程式计算剩余气体的体积;
D、设原氨气体积为VL,根据![]() 计算;
计算;
A、只有浓盐酸才能与二氧化锰发生反应生成氯气,随着反应的进行,盐酸的浓度变稀将不再反应,所以0.5L、8mol/L浓盐酸与足量MnO2完全反应产生Cl2的体积小于22.4L(标准状况下),故A错误;
B、该反应中,硫化氢作还原剂,氧化产物为S,二氧化硫作氧化剂,还原产物为S,由于硫化氢与二氧化硫的物质的量之比为2:1,所以氧化产物与还原产物的物质的量之比也为2:1,故B错误;
C、将NO2和O2等体积混合充满一试管,倒置于水槽中,发生![]() ,设试管的体积为8,则NO2和O2体积都是4,根据方程式,4体积的NO2消耗1体积的氧气,剩余氧气的体积为3,所以试管中剩余气体占试管容积的3/8,故C错误;
,设试管的体积为8,则NO2和O2体积都是4,根据方程式,4体积的NO2消耗1体积的氧气,剩余氧气的体积为3,所以试管中剩余气体占试管容积的3/8,故C错误;
D、设原氯化氢气体体积为VL,则标准状况下![]() ,当水充满整个烧瓶后,溶液体积为为VL,
,当水充满整个烧瓶后,溶液体积为为VL,![]()
![]() mol/L,故D正确。
mol/L,故D正确。


科目:高中化学 来源: 题型:
【题目】由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是
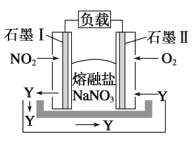
A. 石墨I极为正极,石墨II极为负极
B. Y的化学式可能为NO
C. 石墨I极的电极反应式为NO2+NO3--e-=N2O5
D. 石墨II极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有以下几种方法:①热分解法;②焦炭法;③水煤气法(CO或H2);④活泼金属置换法;⑤电解法。这几种方法各有优缺点,它们在工业上均有应用。古代有:a.火烧孔雀石炼铜;b.湿法炼铜;现代有:c.铝热法炼铁;d.光卤石法炼镁。对它们的冶炼方法分析不正确的是
A. a用② B. b用③ C. c用④ D. d用⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
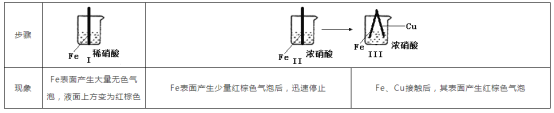
下列说法中不正确的是
A. Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 过量铁与稀硝酸反应生成亚铁盐
D. 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下:
____ FeS2+ ____ H++ ____ NO3-= ____ Fe2++ ____ S↓+ ____ NO↑+ ____H2O
回答下列问题:配平此氧化还原反应方程式_____________________________________,还原剂为______________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是_____(填字母)
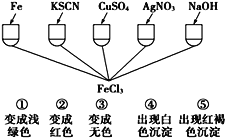
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用如下装置用环己醇制备环己烯。
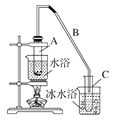
已知:环己醇和浓硫酸混合在85 ℃下制取环己烯。
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是____________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A. KMnO4溶液 B. 稀硫酸 C. Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________________________。
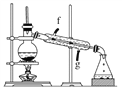
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是___________;如果得实际得到产品质量为8.2 g, 则该实验的产率是_________________(保留3位有效数字)。
a. 用酸性高锰酸钾溶液 b. 用金属钠 c. 测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,11.2L CO2所含的原子数为1.5NA
B. 标准状况下,22.4L H2和N2的混合物中所含原子数为NA
C. 标准状况下,11.2L SO3 中含有2NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com