
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ②④⑤ |
分析 可逆反应A(s)→B(g)+2C(g)为气体体积增大的反应,该反应达到平衡状态时,正反应速率与逆反应速率相等,各组分的浓度、百分含量不再变化;注意A为固体,反应过程中气体的总质量发生变化,据此进行解答.
解答 解:①A的质量不变,表明正逆反应速率相等,该反应达到平衡状态,故①不选;
②由于该反应中A为固体,而生成气体B、C的物质的量之比始终为1:2,则气体的平均摩尔质量始终不变,不能用平均摩尔质量判断平衡状态,故②选;
③该反应为气体体积增大的反应,若容器中压强不变,说明各组分的浓度不再变化,该反应已经达到平衡状态,故③不选;
④B、C两种气体的体积之比始终为1:2,则反应过程中B的体积分数始终不变,不能用体积分数判断平衡状态,故④选;
⑤生成1molC的同时消耗2molB,表示的是正逆反应速率,但是不满足计量数关系,说明该反应没有达到平衡状态,故⑤选;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,②、④为易错点,注意该反应中B、C两种气体的物质的量之比始终为1:2,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
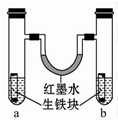 如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间.
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
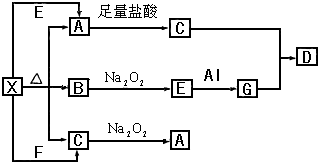
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
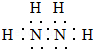 ,其中氮的化合价为-2.
,其中氮的化合价为-2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com