
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B. 向滴有酚酞的硅酸钠溶液中边加边振荡地滴加盐酸至红色变浅并接近消失:2H++SiO32-=H2SiO3(胶体)
C. 惰性电极电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、Z-、W2四种离子均具有相同的电子层结构
、Z-、W2四种离子均具有相同的电子层结构![]() 下列关于X、Y、Z、W四种元素的描述,不正确的是
下列关于X、Y、Z、W四种元素的描述,不正确的是![]()
![]()
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y>W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝合金与硝酸恰好完全反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下3.36 L O2混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2 mol/L NaOH溶液至沉淀最多时停止加入,将沉淀滤出,向滤液中加水稀释至500 mL,此时所得溶液的物质的量浓度为( )
A. 0.5 mol/LB. 1 mol/L
C. 1.2 mol/LD. 2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
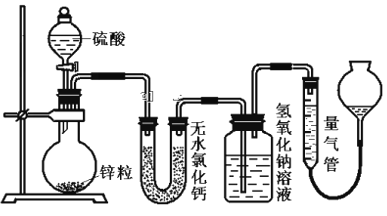
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ (选填:200,400,500) mL 。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:_______________________
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到V mL气体,则有: ![]() =
=![]() +
+![]() ,依据的原理是____________________________。
,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,![]() =_______________(用含字母的代数式表示)。
=_______________(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
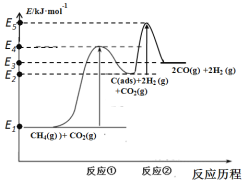
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题,其综合利用具有重要意义。回答下列问题:
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)![]() 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=_________。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L-2。
(2)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3)∶c(CO32 -)=2∶1,溶液pH=____。(室温下,H2CO3的K1=4×10-7;K2=5×10-11),0.1mol·L-1 NaHCO3溶液中阴离子的浓度由大到小的顺序为______________
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在_______极,该电极反应式是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香醛是常用的一种食用香精。存在下列转化关系:
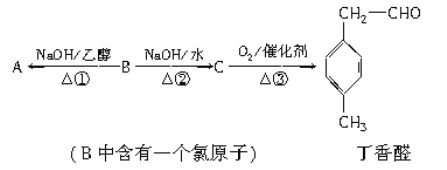
(1)B的分子式为________,C中含氧官能团的名称为________。
(2)反应②的化学方程式为____________________________________。
(3)A发生加聚反应所得产物的结构简式为________________。
(4)与A含有相同官能团的芳香族化合物的同分异构体还有________种(不考虑顺反异构),其中只有一个取代基且不含甲基的物质的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g) + Y(g)![]() Z(g)。反应过程中测定的部分数据如下表:
Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A. 反应1~2min末的平均速率v(Z)=0.2mol/(L·min)
B. 在2min~4min间,v(X)正>v(Y)逆
C. 生成1mol Z的同时,生成1mol X能说明该反应已达化学平衡状态
D. 其他条件不变,再充入1.2mol X,X的转化率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能( )
A. H2SO4 B. NaOH C. AgNO3 D. Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com