
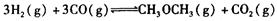
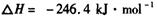
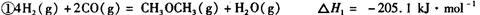

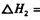 :__________________ ______________
:__________________ ______________ 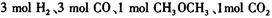 ,在一定温度和压强下发生反应:
,在一定温度和压强下发生反应: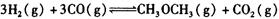 ,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率
,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①反应开始时正、逆反应速率 的大小:V(正)____V(逆)(填“ >”、“ < ”或"="),理由是:________________________________
的大小:V(正)____V(逆)(填“ >”、“ < ”或"="),理由是:________________________________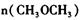 =_________________,平衡时CO的转化率= _________________。
=_________________,平衡时CO的转化率= _________________。科目:高中化学 来源:不详 题型:单选题
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1c(B)="0.200" mol·L-1 c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1c(B)="0.200" mol·L-1 c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。
 C的△H>0
C的△H>0查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Ur-(尿酸根,aq) + H+(aq) (37℃时,Ka =4.0×10-6)
Ur-(尿酸根,aq) + H+(aq) (37℃时,Ka =4.0×10-6) Ur-(aq) + Na+(aq)
Ur-(aq) + Na+(aq) | A.c(HUr) > c(Ur-) | B.pH > 7 |
| C.c(Na+)=c(HUr)+c(Ur-) | D.2 c(H+)=2 c(OH-)+[c(Ur-) -c(HUr)] |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是
2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是| A.①②④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
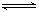 p C在某温度下达到平衡。
p C在某温度下达到平衡。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
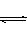 3C(g),若反应开始时充入2 mol A和2 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
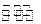 2TaS2(s)+2I2(g),t min后达到平衡,此时生成2a mol I2。下列说法正确的是 ( )
2TaS2(s)+2I2(g),t min后达到平衡,此时生成2a mol I2。下列说法正确的是 ( )A.用TaI4表示此反应的反应速率是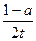 mol/(L·min) mol/(L·min) |
| B.向平衡后的体系中加入lmol TaS2,平衡向逆反应方向移动 |
| C.给平衡后的体系升温,化学平衡一定移动 |
| D.向平衡后的体系中充入lmol TaI4,v(正)增大,v(逆)减小,平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com