
不能在有机物分子中直接引入官能团羟基的反应类型是
A.取代反应 B.消去反应 C.加成反应 D.水解反应
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源:2013-2014河南省濮阳市高一下学期升级考试化学(A卷)试卷(解析版) 题型:选择题
下列说法正确的是
A.天然气和沼气的主要成分是乙烯,它们都属于不可再生能源
B.煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料
C.石油分馏得到的汽油、煤油、柴油等都是混合物,但有固定的熔沸点
D.石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等)
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:填空题
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:

①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
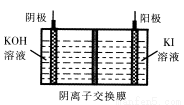
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:选择题
某有机物能跟新制的氢氧化铜反应生成红色沉淀,相对分子质量为44。燃烧该有机物2.2 g生成2. 24 L(标准状况)CO2。下列说法不正确的是
A.该有机物属于醛类
B.1 mol该有机物一定条件下能与l mol H2加成
C.燃烧该有机物4.4 g,生成1.8 g水
D.0. 01 mol该有机物与足量银氨溶液充分反应,析出金属银2.16 g
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省洛阳市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列有关化学用语使用正确的是
A. CH4分子的比例模型: B.乙醇的分子式:CH3CH2OH
B.乙醇的分子式:CH3CH2OH
C.苯的最简式:C6H6 D.乙烯的结构简式:CH2CH2
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二上学期期末考试化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省安阳市高三毕业班第二次模拟理综化学试卷(解析版) 题型:简答题
溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高二下学期6月联考化学试卷(解析版) 题型:填空题
已知物质A分子式为C3H4O2,显酸性。F为由七个原子组成的环状结构,分子式为C6H8O4。请根据以下框图回答问题:
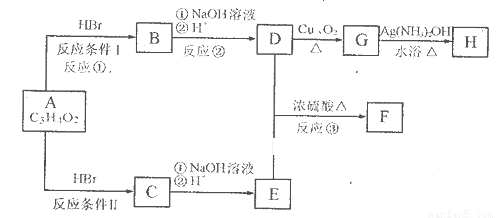
(1)A的结构简式为________________________________。
(2)反应①的反应类型为__________________________。
(3)化合物B中含氧官能团的名称是______________________________。
(4)D和E生成F的化学方程式__________________________________。
D和E按照1:1反应也可生成高聚物,请写出生成该高聚物的化学反应方程式=______
________________________________________________________________________。
(5)G生成H的化学方程式________________________________________________。
(6)写出C的同分异构体中属于酯类物质的结构简式_______________________、
________________________、____________________________________(至少写3个)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com