
【题目】反应2KMnO4=K2MnO4+MnO2+O2↑已知158g KMnO4反应生成了16g O2,则固体残余物的质量是
A. 16g B. 32g C. 126g D. 142g
科目:高中化学 来源: 题型:
【题目】利用相关知识填空。
(1)标准状况下,11.2LNH3中含______个氨分子。
(2)等质量的SO2和SO3物质的量之比是______;所含的氧原子个数之比是______。
(3)4.8g CH4中所含氢原子数与______g水所含氢原子数相等。
(4)24.8gNa2R含Na+0.8mol,则Na2R的摩尔质量为______。
(5)标况下,一定量的N2与22.4LCO所含电子的物质的量相等,则N2的质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置______![]()
![]() 填代表装置图的字母,下同
填代表装置图的字母,下同![]()
![]() ;除去自来水中的Cl_等杂质,选择装置______。
;除去自来水中的Cl_等杂质,选择装置______。
(2)从碘水中分离出I2的分离方法的名称为______。
(3)装置A中①的名称是______,进水的方向是从______口进水![]() 。
。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
粗盐中含Fe3+、Mg2+、Ca2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量BaCl2的![]() 溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是______(填选项字母) 。
溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是______(填选项字母) 。
A.⑤②③①⑥④⑦ B.⑤①②③⑥④⑦ C. ⑤②①③④⑥⑦ D.⑤③②①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如下:
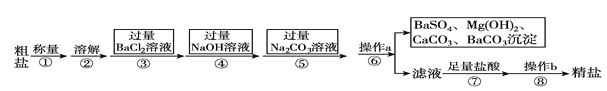
(1)操作a的名称为________,在操作b中玻璃棒的作用是_____________________。
(2)进行步骤③后,判断BaCl2过量的方法是______________________________(写出步骤、现象)。
(3)步骤⑦中能用稀硫酸代替稀盐酸吗?________(填“能”或“不能”),原因是_____________。
(4)某氯化钾样品中含杂质硫酸钾,为了除去硫酸钾,要做以下实验:
A.向滤液中滴加稀盐酸,边滴边振荡至不再产生气体
B.将氯化钾样品溶于适量蒸馏水,配成溶液
C.过滤,将白色沉淀滤出
D.向溶液中加入过量碳酸钾溶液,边滴边振荡至不再产生白色沉淀
E.向溶液中加入过量氯化钡溶液,边滴边振荡至不再产生沉淀
F.将滤液蒸干,得到晶体
①正确的实验操作顺序为______________(填写序号)。
②进行F操作时用到的仪器主要有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl-、NO![]() 、CO
、CO![]() 中不同的阴、阳离子组成。经实验验证知:A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为_______、B为_________。将B和C的溶液混合后,发生反应的离子方程式为________________。
中不同的阴、阳离子组成。经实验验证知:A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为_______、B为_________。将B和C的溶液混合后,发生反应的离子方程式为________________。
(2)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:

从实验可以判断,该固体粉末中一定不含有____________,它的组成可能是__________或_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在___________对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为__________________________。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |

①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O) 俗名“大苏打”。易溶于水,难溶于乙醇,沸点为100℃,酸性或加热条件下易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
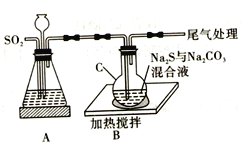
回答下列问题:
(1)装置A可用于观察SO2的生成速率,其中的液体最好选择_____________(填序号)。若装置堵塞使气流不畅,则A中的现象为_______________________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
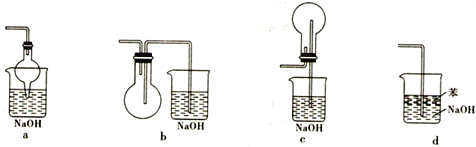
(2)尾气处理可以选择以下装置中的________(填序号)。
(3)反应过程中若pH值小于7则会降低产率,请用离子方程式解释原因:_________________________。
(4)请写出装置C中发生反应的化学方程式:_________________________。
(5)反应结束后,取C中混合物趁热过滤,取滤液于蒸发皿中, ______________,抽滤,洗涤,低温下干燥得产品。洗涤时要尽量减少产品的损失,其具体操作是_________________________。
(6)为检验制得的产品的纯度,该实验小组称取4g 的产品配制成250mL 硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入20mL 0.0lmol·L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+ S4O62-,实验数据如下表:
实验序号 | 1 | 2 | 3 |
Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.2 |
当滴入最后一滴Na2S2O3溶液时,溶液___________,且半分钟内不变化,则达到终点。计算该产品的纯度是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)用双线桥法表示此反应的电子转移的方向及数目_____________
(2)该反应的氧化剂是______,还原剂是________。HCl表现 ___________性和 ____性。
(3)若消耗0.2 mol氧化剂,转移电子的物质的量是________ mol。生成氯气在标准状况下的体积是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com