
| A. | NaOH | B. | CaCl2 | C. | NH3 | D. | HCl |
科目:高中化学 来源: 题型:推断题
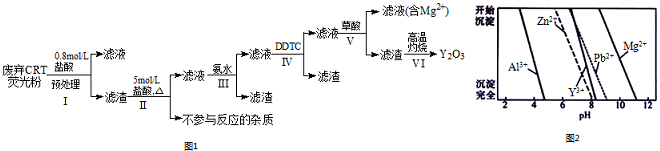
| 阶段/含量%/成分 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯化与水解反应均要用浓硫酸作催化剂 | |
| B. | 酯化与水解反应均可用Na0H作催化 | |
| C. | 酯类物质可用Na0H作催化剂,不宜用浓硫酸作催化剂 | |
| D. | 酯化反应使用浓硫酸作催化剂有利于反应向左进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | NO、O2、H2 | D. | SO2、CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 C、Be、Cl、Fe等元素及其化合物有重要的应用.
C、Be、Cl、Fe等元素及其化合物有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
 ;由H和①形成的原子数之比为1:1的物质
;由H和①形成的原子数之比为1:1的物质 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{49}^{115}$In原子核外有49个电子 | |
| B. | ${\;}_{49}^{115}$In原子核内有49个中子 | |
| C. | ${\;}_{49}^{115}$In原子核内质子数和中子数之和等于其质量数,为115 | |
| D. | ${\;}_{49}^{115}$In是In元素的一种核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com