
【题目】(1)在25℃条件下将pH=12的氨水稀释过程中,下列说法正确的是___。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中![]() 比值增大
比值增大
D.此过程中Kw增大
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是____(填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2molNH4Cl和0.1molNaOH全部溶于水,形成混合溶液(假设无损失)。
①___和___两种粒子的物质的量之和等于0.2mol。
②____和___两种粒子的物质的量之和比OH-多0.1mol。
【答案】B ③ NH4+ NH3·H2O NH4+ H+
【解析】
(1)A.氨水稀释,溶液中c(NH4+)、c(OH-)都减小,所以c(NH4+)·c(OH-)减小,A不正确;
B.c(H+)·c(OH-)为水的离子积常数,温度一定时,水的离子积常数不变,B正确;
C.![]() ,温度不变时,比值不变,C不正确;
,温度不变时,比值不变,C不正确;
D.此过程中Kw不变,D不正确。
故答案为B。
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是溶液中c(NH4+)增大,抑制一水合氨的电离,使电离平衡逆向移动,所以溶液的pH减小。
答案为③;
(3)室温下,如果将0.2molNH4Cl和0.1molNaOH全部溶于水,形成混合溶液(假设无损失)的成分为:0.1molNH4Cl、0.1mol NH3·H2O、0.1molNaCl。
主要发生的反应是:NH3·H2O![]() NH4++OH-
NH4++OH-
起始量 0.1mol 0.1mol 0
变化量 x x x
平衡量 0.1-x 0.1+x x
H2O![]() H++OH-
H++OH-
y y y
①NH4+和NH3·H2O两种粒子的物质的量之和等于0.2mol。
答案为:NH4+、NH3·H2O;
②. NH4+和H+两种粒子的物质的量之和比OH-多0.1mol。
答案为:NH4+、H+。


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】锂离子电池正极材料需要纯度较高的硫酸锰,目前工业硫酸锰中杂质(钙、镁、铁等)含量高,利用下图流程可制取纯度较高的硫酸锰溶液。

反应①使杂质生成氟化物的沉淀,对反应①前后的杂质含量检测结果(以350g/LMnSO4计)如下:
杂质 | 净化前/g | 净化后/g | 去除率/% |
Fe2+、Fe3+ | 0.001275 | 0.001275 | ﹣ |
Ca2+ | 0.490000 | 0.021510 | 95.61 |
Mg2+ | 0.252000 | 0.025100 | 90.04 |
(1)滤渣x中含有的物质是_____。
(2)试分析钙镁去除结果不同的原因:_____。
(3)在滤液中加入KMnO4可以将Fe2+氧化为Fe3+,同时生成Mn2+.该反应的离子方程式为_____。
(4)已知:生成氢氧化物沉淀的pH
Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 6.3 | 1.5 | 8.3 |
完全沉淀时 | 8.3 | 2.8 | 9.8 |
注:金属离子的起始浓度为0.1mol/L
根据表中数据解释流程中②的目的:_____。
(5)进一步研究表明,如果反应①后不过滤直接加入KMnO4,同时控制加入的量,反应后调节pH,然后再过滤,可以进一步提高钙镁的去除率.钙镁去除率提高的原因有如下假设:
假设I:Fe2+与生成了Fe3+,Fe3+水解生成的Fe(OH)3吸附了沉淀物;
假设II:Mn2+与反应生成的活性MnO2吸附了沉淀物。
选择适当的无机试剂,设计实验验证假设是否成立____________________。
(6)锂离子电池充放电过程中,锂离子在正极和负极之间来回移动,就像一把摇椅,称“摇椅式电池”。典型的锂离子电池工作原理如图所示。

①放电时Li+的移动方向从__________极到极_____(填“a”或“b”)。
②已知电极总反应:LiCoO2+C![]() Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
平昌冬奥会闭幕式上,“2022,相约北京”文艺表演蕴含了丰富的中国文化,展现了新时代中国形象。


熊猫木偶:熊猫木偶高2.35m,质量仅为10kg,用铝合金管材和碳纤维条做框架,配合LED灯制作而成。其中,碳纤维是含碳量高于90%的新型材料,密度比铝小,强度比钢大。
智能机器人:中国新一代智能机器人与轮滑舞者共舞、互动,在导航精准性、动作复杂性和灵活性等方面,实现了人工智能领域的升级创新。
石墨烯智能发热服:这种智能发热服可在20℃的条件下持续发热4h。石墨烯是一种由碳原子构成的六角型二维碳纳米材料,具有超高硬度、强度和导热系数等特性。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)熊猫木偶、智能机器人、石墨烯智能发热服展现了“中国智慧”。_____。
(2)碳纤维具有优良的性能,将有广泛的应用前景。_____。
(3)中国新一代智能机器人在动作、导航等方面实现了人工智能领域的升级创新。_____。
(4)石墨烯和石墨由同种元素组成,但它们的物理性质差异较大。_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. CaCO3的电离方程式:CaCO3 ![]() Ca2++CO32-
Ca2++CO32-
B. H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,可采取的措施为( )
A.通入二氧化碳气体B.加入氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000 mol/L NaOH溶液滴定未知浓度的盐酸溶液,操作可分解为如下几步:
A.用蒸馏水洗干净滴定管;B. 用待测定的溶液润洗酸式滴定管;C.用酸式滴定管取稀盐酸20.00 mL,注入锥形瓶中,加入酚酞;D.另取锥形瓶,再重复操作一次;E.检查滴定管是否漏水;F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)_____________。
(2)操作F中应该选择图中________滴定管(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应观察________。
A. 滴定管内液面的变化 B. 锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是____________________________。
(4)滴定结果如表所示:
滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20 | 1.02 | 21.03 |
2 | 20 | 2.00 | 25.00 |
3 | 20 | 0.60 | 20.60 |
滴定中误差较大的是第________次实验,造成这种误差的可能原因是________。
A. 碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B. 滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C. 滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D. 达到滴定终点时,仰视溶液凹液面最低点读数
E. 滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为________mol/L。
(6)如果准确移取20.00 mL 0.1000 mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2可转化成有机物实现碳循环。在容积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
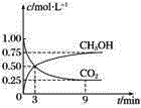
(1)从3 min到9 min,v(H2)=________ mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是________(填字母)。
A 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B 混合气体的密度不随时间的变化而变化
C 单位时间内消耗3 mol H2,同时生成1 mol H2O
D CO2的体积分数在混合气体中保持不变
(3)一定温度下,第9 min时v逆(CH3OH)________(填“大于”“小于”或“等于”)第3 min时v正(CH3OH)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
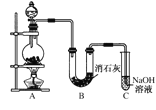
(1)A为实验室制氯气的发生装置,反应化学方程式为_________________________;某学生用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2________6.72 L(填“<”、“>”或“=”)。
(2)漂白粉将在U形管中产生,其化学方程式是_________________________________。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,可将装置作何改进______________________________。
(4) C装置的作用是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O,Na2S2O35H2O于4045℃熔化,48℃分解:Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图1所示。
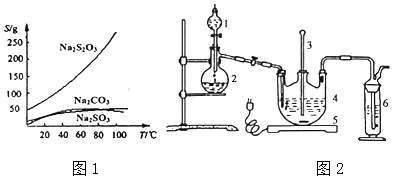
I.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓硫酸,在装置2中加入亚硫酸钠固体,并按如图2示安装好装置。
(1)仪器2的名称为___,装置6中可加入___。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2
②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O
④Na2SO3+S![]() Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:___(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量:
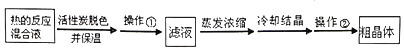
(3)为减少产品的损失,操作①为___,操作②是抽滤洗涤、干燥,其中洗涤操作是用___(填试剂名称)作洗涤剂。
(4)蒸发浓缩滤液,直至溶液呈微黄色浑浊为止。蒸发时要控制温度不宜过高,其原因是___。
(5)制得的粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定杂质与酸性KMnO4溶液不反应)。称取1.28g粗样品溶于水,用(0.40mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O![]() 全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O
全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O![]() +8MnO
+8MnO![]() +14H+=8Mn2++10SO
+14H+=8Mn2++10SO![]() +7H2O)
+7H2O)
试回答:
①滴定终点时的颜色变化___
②产品中Na2S2O35H2O的质量分数为___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com