
 已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.
已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.分析 A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素,则A为H元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同,原子核外电子排布为1s22s22p2,则B为碳元素;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍,原子核外电子排布为1s22s22p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E位于ds区,且原子的最外层电子数与A的相同,则E为Cu,据此解答.
解答 解:A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素,则A为H元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同,原子核外电子排布为1s22s22p2,则B为碳元素;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍,原子核外电子排布为1s22s22p4,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E位于ds区,且原子的最外层电子数与A的相同,则E为Cu.
(1)同周期随原子序数增大,元素第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,故答案为:N>O>C;
(2)E为Cu元素,基态原子的价电子排布式是3d104s1,故答案为:3d104s1;
(3)C、N两元素均可形成含18个电子氢化物分子,其氢化物分子分别以X、Y表示,则X为C2H6、Y为N2H4,
①N2H4分子之间存在氢键,C2H6分子之间无氢键,二者沸点相差较大,故答案为:N2H4分子之间存在氢键,C2H6分子之间无氢键;
②碳元素形成的另一种氢化物Z,其分子中含14个电子,则Z为C2H4,结构式为 ,C原子形成3个σ键,没有孤电子对,故碳原子采取sp2杂化,σ键和π键之比为5:2,故答案为:sp2;5:2;
,C原子形成3个σ键,没有孤电子对,故碳原子采取sp2杂化,σ键和π键之比为5:2,故答案为:sp2;5:2;
(4)以顶点C原子为研究,与相邻的原子处于棱中心,每个顶点为8个晶胞共用,棱中心原子为4个晶胞共用,故C原子配位数为$\frac{3×8}{4}$=6,故答案为:6.
点评 本题是对物质结构的考查,推断元素是解题关键,涉及核外电子排布、电离能、氢键、杂化方式、化学键、晶胞计算等,是对学生综合能力的考查.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气光照下反应的生成的氯代物都是气体 | |
| B. | 正丁烷的四个碳原子在同一条直线上 | |
| C. | 正丁烷的熔点、沸点都比异丁烷小 | |
| D. | 分子式为CnH2n+2分子中共用电子对数为3n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2,4-二甲基已烷
2,4-二甲基已烷 3-甲基-1-丁烯
3-甲基-1-丁烯



 +3HO-NO2
+3HO-NO2
 +3H2O
+3H2O CH2=CHCl.
CH2=CHCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应②配平后,H2O的化学计量数为5 | |
| B. | Fe3O4既可看作是氧化物,又可看作是亚铁盐 | |
| C. | 反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 | |
| D. | 碱性条件下,NaNO2的氧化性比Na2FeO2强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. )不能与强碱性物质混合使用,其原因是
)不能与强碱性物质混合使用,其原因是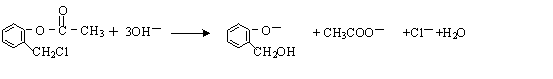 (写离子方程式).
(写离子方程式). )通过加成、取代等一系列转化合成某高分子化合物
)通过加成、取代等一系列转化合成某高分子化合物
 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与足量盐酸混合:Ca(HCO3)2+2H+═Ca2++2CO2↑+2H2O | |
| B. | Na2CO3溶液中通入CO2气体:CO${\;}_{3}^{2-}$+CO2+H2O═2HCO${\;}_{3}^{-}$ | |
| C. | 实验室用NH4Cl固体与Ca(OH)2固体混合制NH3:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO${\;}_{3}^{2-}$+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电离方程式:HClO?H++ClO- | |
| B. | 铝溶于烧碱溶液的离子方程式:Al+2OH-═AlO2-+H2↑ | |
| C. | 电解精炼铜的阴极反应式:Cu-2e-═Cu2+ | |
| D. | NaHS水解的离子方程式:HS-+H2O?H3O+S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8-2m+n | B. | 2m-n | C. | 2m-n-8 | D. | n-2m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com