
���� ��1�������ʵ�����Na2O2��Na2O�ֱ���ˮ��Ӧ���ɵ����ʵ�����NaOH�����ĵ�ˮ������ͬ�����ɵ�OH-Ũ����ͬ����ԼΪ0.2mol/L��Na2CO3��ˮ�⣬ʹ������Ũ��������CO32-+H2O?HCO3-+OH-��
��2������������ԭ��Ӧ�����غ�����жϲ������ƽ��ѧ����ʽ��ȼ�ϵ�أ�ȼ���ڸ���ʧ���ӷ���������Ӧ��
��3��NaHCO3���ȶ��������ֽ⣬���������ı仯���ò�ֵ�����
��4����Ϸ�Ӧ�ķ���ʽ2Na+2H2O�T2NaOH+H2����2K+2H2O�T2KOH+H2�����㣮
��� �⣺��1���ɢٷ�ӦΪ2Na2O2+2H2O=4NaOH+O2�����ڷ�ӦΪNa2O+H2O=2NaOH����ˮ���������ĵ�ˮ������ͬ�����ɵ����ʵ�����NaOH�������ɵ�OH-Ũ����ͬ����ԼΪ0.2mol/L����Ϊ��=�ڣ�����̼���ˮ��ʹ��������Ũ���Դ��ڢܣ�������NaCl��Ũ��Ϊ0.1mol/L����������Һ��������Ũ�ȵĴ�С˳���Ǣ�=�ڣ��ۣ��ܣ�
�ʴ�Ϊ����=�ڣ��ۣ��ܣ�
��2��NH3��NaClO��Ӧ�ɵõ��£�N2H4������Ԫ�ػ��ϼ����߱���������������������������ԭΪ�Ȼ��ƣ���ѧ����ʽΪ2NH3+NaClO=N2H4+NaCl+H2O����--����ȼ�ϵ����һ�ּ��Ե�أ��õ�طŵ�ʱ����������ȼ�����ɵ�����ˮ�������ĵ缫��ӦʽΪ��N2H4-4e-+4OH-=N2+4H2O��
�ʴ�Ϊ��2NH3+NaClO=N2H4+NaCl+H2O��N2H4+4OH--4e-=4H2O+N2��
��3��NaHCO3���ȶ��������ֽ⣬����2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����
��2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2����m
168g 106g 62g
x bg
x=$\frac{168b}{62}$g��
����Ʒ��Na2CO3������Ϊag-$\frac{168b}{62}$g=$\frac{62a-168b}{62}$g��
���Ըû������Ʒ��Na2CO3������������$\frac{62a-168b}{62a}$=$\frac{31a-84b}{31a}$��
�ʴ�Ϊ��$\frac{31a-84b}{31a}$��
��4�����ơ��ص����ʵ����ֱ�Ϊa��b����Ӧ�ķ���ʽΪ2Na+2H2O�T2NaOH+H2����2K+2H2O�T2KOH+H2����
��a+b=0.075mol��2=0.15mol��
����Һ�����������ӵ����ʵ���Ũ����$\frac{0.15mol}{0.2L}$=0.75mol/L��
�ʴ�Ϊ��0.75��mol/L����
���� ���⿼���Ϊ�ۺϣ��漰������ĵ����Լ����������ʣ�������ѧ���ķ��������ͼ��������Ŀ��飬ע����������Ϣ��ѧϰ��ע����ػ���֪ʶ�Ļ��ۣ����ݷ�Ӧ�ķ���ʽ�����⣬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\stackrel{+4}{Mn}$O2��$\stackrel{+2}{Mn}$SO4 | B�� | Al 2O 3��Al��OH�� 3 | C�� | $\stackrel{-1}{KI}$��K$\stackrel{+5}{I}$O3 | D�� | HNO 3��NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ������������CnH m������̼ԭ����n��Cԭ�ӣ��뺬̼��C%�Ĺ�ϵ��
��ͼ������������CnH m������̼ԭ����n��Cԭ�ӣ��뺬̼��C%�Ĺ�ϵ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �ڣ�t1+10��minʱ�������������䣬����ѹǿ��ƽ�����淴Ӧ�����ƶ� | |
| B�� | ��t1+10��minʱ������������ѹǿ���䣬ͨ��ϡ�����壬ƽ�������ƶ� | |
| C�� | T��ʱ������ͬ�����У�����0.3 mol•L-1 A��0.1 mol•L-1 B��0.4 mol•L-1C��Ӧ���ﵽƽ���C��Ũ����Ϊ0.4 mol•L-1 | |
| D�� | �÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ���A��ת�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ������˵����ȷ���ǣ�������
������˵����ȷ���ǣ�������| A�� | ��ԭ��λ�ڵ������ڣ���A�� | B�� | ��ԭ��λ�ڵ������ڣ���B�� | ||
| C�� | ��ԭ��λ�ڵ������ڣ���B�� | D�� | ��ԭ��λ�ڵ������ڣ���A�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪A��B��C��D��E����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�B�Ļ�̬ԭ���е���ռ��������������ͬ��ԭ�ӹ�����������ֹ���еĵ�������ͬ��Dλ�ڵ�2���ڣ���ԭ�Ӻ���ɶԵ�������δ�ɶԵ�������3����Eλ��ds������ԭ�ӵ�������������A����ͬ��
��֪A��B��C��D��E����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�B�Ļ�̬ԭ���е���ռ��������������ͬ��ԭ�ӹ�����������ֹ���еĵ�������ͬ��Dλ�ڵ�2���ڣ���ԭ�Ӻ���ɶԵ�������δ�ɶԵ�������3����Eλ��ds������ԭ�ӵ�������������A����ͬ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
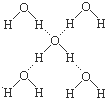 �����йر���˵���У���ȷ������ǣ�������
�����йر���˵���У���ȷ������ǣ�������| A�� | ������ | B�� | ������ | C�� | ���ܢݢ��� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com