
科目:高中化学 来源:2012届广东省连州市连州中学高三10月月考理科综合化学试卷(带解析) 题型:计算题
(16分)甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g) 
(1)已知:



1 mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为 。
和水蒸气的热化学方程式为 。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是 (双选)。
CH3OH(g)反应速率的是 (双选)。
| A.分离出CH3OH | B.升高温度 | C.减小压强 | D.加入合适的催化剂 |

 CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程)查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省天水市一中高一第一次月考化学试卷(带解析) 题型:实验题
(20分)掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

I II
⑴写出下列仪器的名称:
a. b. c.
⑵仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水由 (填f或g)口通入, 口流出。
⑷现需配制0.1 mol· L-1NaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和天平外,为完成实验还需要的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ____。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④配制0.1 mol· L-1NaOH溶液的实验中,如果出现以下操作:
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
上述操作中对配制的溶液物质的量浓度大小造成(填写字母)偏大的有 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年东北三省三校高三第一次联合模拟考试理综化学试卷(解析版) 题型:实验题
环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下:

环己醇和环己酮的部分物理性质见下表:
|
物质 |
相对分子质量 |
沸点(℃) |
密度(g·cm—3、20 ℃) |
溶解性 |
|
|
环己醇 |
100 |
161.1 |
0.9624 |
能溶于水和醚 |
|
|
环己酮 |
98 |
155.6 |
0.9478 |
微溶于水,能溶于醚 |
|
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
A.蒸馏、除去乙醚后,收集151℃~156℃馏分
B.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
C.过滤
D.往液体中加入NaCl固体至饱和,静置,分液
E.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是 。
(2)b中水层用乙醚萃取的目的是 。
(3)从下关于萃取分液操作的叙述中,不正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡

B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作D中,加入NaCl固体的作用是 。蒸馏除乙醚的操作中采用的加热方式为 。
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是 。
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省天水市高一第一次月考化学试卷(解析版) 题型:实验题
(20分)掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
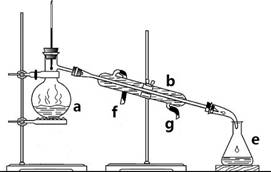
I II
⑴写出下列仪器的名称:
a. b. c.
⑵仪器a~e中,使用前必须检查是否漏水的有 。(填序号)
⑶若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水由 (填f或g)口通入, 口流出。
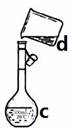
⑷现需配制0.1 mol· L-1NaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和天平外,为完成实验还需要的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ____。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④配制0.1 mol· L-1NaOH溶液的实验中,如果出现以下操作:
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
上述操作中对配制的溶液物质的量浓度大小造成(填写字母)偏大的有 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省连州市高三10月月考理科综合化学试卷(解析版) 题型:计算题
(16分)甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
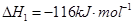
(1)已知: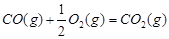
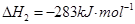
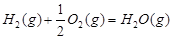
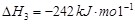
1
mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为
。
和水蒸气的热化学方程式为
。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是
(双选)。
CH3OH(g)反应速率的是
(双选)。
A.分离出CH3OH B.升高温度 C.减小压强 D.加入合适的催化剂
(3)(3)用H2和CO化合制备甲醇的反应中,若反应的容积为1L的恒容容器,分别在230℃、250℃和270℃下,改变H2和CO的起始组成比(起始时CO的物质的量固定为1mol)进行实验,结果如下图所示(图中曲线上的点都为一定温度下、一定组成下的平衡点):
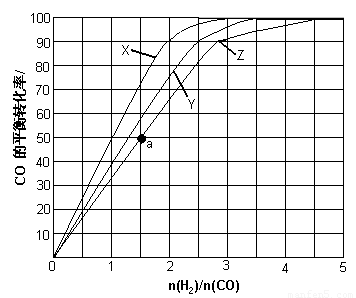
①曲线X对应的温度是 。
②从图中可以得出的结论有 (任写一条)。
(4)若往反应的容积中加入1.5molH2 和1.0molCO,在曲线Z对应温度下反应达平衡。利用上述图中a点对应的CO平衡转化率,计算2H2(g)+CO(g) CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com