
如右图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )

①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④ C.③④ D.②③
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
下列过程中,没有发生化学变化的是 ( )
A.干冰用于人工降雨
B.蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀
C.溶洞中钟乳石的形成
D.工业上合成氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以黄铁矿(主要成分FeS2)为原料生产硫酸, 其中重要的一步是催化氧化:
其中重要的一步是催化氧化:
2SO2(g)+O2(g) 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
将一定量的SO2和空气放入体积不变的密闭容器中进行反应。请回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;
(2)判断该反应达到平衡状态的标志是 。
A.SO2、O2、SO3浓度之比为2:1:2
B.SO2百分含量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
E.容器中混合气体的密度保持不变
(3)在一密闭容器中充入amolSO2和一定量O2,当放出393.2kJ热量时,a的数值为 。
A. 4 B.<4 C.>4 D.无法判断
(4)下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.增大容器的体积
C.向装置中再充入O2 D.及时分离出SO3
E.向装置中再充入一些SO2 F.改变反应的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
A.向氯化亚铁溶液中通入氯气 Fe2++Cl2 Fe3++2Cl-
B.氯气通入冷的氢氧化钠溶液中 Cl2+2OH- Cl-+ClO-+H2O
C.铝片跟氢氧化钠溶液反应: Al+2OH-=AlO2-+H2↑
D.澄清石灰水中通入过量二氧化碳:Ca2+ +2OH- +CO2 ===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
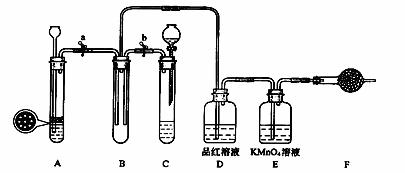
某课外学习小组的同学设计了如图的装置,以验证SO2的氧化性、还原性和漂白性。
请回答以下问题:
(1)用Na2SO3固体粉末和稀硫酸溶液制取SO2气体,应选用_____(选“A”或“C”)。
(2)课外学习小组的同学用FeS固体(块状,不溶于水)和稀硫酸制取H2S气体,反应的方程式为FeS + H2SO4 = FeSO4 + H2S↑,应选用_____(选“A”或“C”)做气体发生装置。请说出上述两个反应选取装置的理由 。
(3)SO2气体通过D装置时现象是 ,通过E装置时现象是 ;SO2与H2S在B装置中反应,现象是__________。
(4)F中盛有碱石灰,其作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:

通过________可以检验流程中滤液2中含有Na+,该实验的具体操作是
。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO )=0.50 mol/L,c(HCO
)=0.50 mol/L,c(HCO )=1×10-2 mol/L,则c(Na+)∶c(OH-)=______________________。
)=1×10-2 mol/L,则c(Na+)∶c(OH-)=______________________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、SO ,另含有Fe2+、Cu2+等杂质。先加入_______(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
,另含有Fe2+、Cu2+等杂质。先加入_______(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为: ___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图。下列有关该氢氧燃料电池的说法错误的是
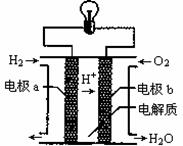 A.该电池工作时将化学能转化为电能
A.该电池工作时将化学能转化为电能
B.电流从电极b经外电路流向电极a
C.该电池中的电极b是正极
D.在电极a上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)查数据得到Ksp(BaSO4)≈1×10-10,Ksp(BaCO3)≈5×10-9,若向BaSO4悬浊液中逐渐加入Na2CO3固体至c(CO )=________mol·L-1时,BaSO4开始向BaCO3沉淀转化。
)=________mol·L-1时,BaSO4开始向BaCO3沉淀转化。
(2)在25℃时某一元酸HA的电离平衡常数Ka=1×10-8,相同物质的量浓度的HA和NaA两溶液等体积混合后,溶液pH_____7(填“<”、“>”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com