
����Ŀ������Ҫ�ش��������⣺
(1)д�����ӷ�Ӧ����ʽ��Ba2+ + SO![]() = BaSO4������Ӧ�Ļ�ѧ��Ӧ����ʽ__________��
= BaSO4������Ӧ�Ļ�ѧ��Ӧ����ʽ__________��
(2)��Ӧ��2Na + O2 ![]() Na2O2��������������____��������O�Ļ��ϼ�Ϊ__��
Na2O2��������������____��������O�Ļ��ϼ�Ϊ__��
(3)ά����C �ֳ�������Ѫ�������ܰ������彫ʳ������ȡ�IJ������յ�Fe3+ת��Ϊ�����յ�Fe2+����˵��ά����C ����_____��(�������Ի�ԭ��)
(4)ij������п��ܺ��п����������Ρ�̼���μ������Ρ�Ϊ�˼��������Ƿ��������Σ�ijͬѧȡ�������������ˮ�������м���_____��Һ���ټ���______��Һ�����а�ɫ�������ɣ����ɴ˵ó��û�����к��������εĽ��ۡ�
���𰸡�Na2SO4+ BaCl2=2NaCl + BaSO4�� Na2O2 -1 ��ԭ�� ϡ���� �Ȼ���
��������
(1)�����Ա���(���)�Ϳ�������(����)��Ӧ�������ᱵ�Ϳ�������(��ǿ�ᡢǿ��)�����ӷ�ӦΪBa2++SO![]() =BaSO4�����ݴ���д��Ӧ�Ļ�ѧ����ʽ��
=BaSO4�����ݴ���д��Ӧ�Ļ�ѧ����ʽ��
(2)���ݻ��ϼ۵ı仯�����������ĸ���������
(3)ά����C��Fe3+ת��Ϊ�����յ�Fe2+�����FeԪ�صĻ��ϼ۵ı仯��������ԭ��Ӧ�Ĺ��ɷ������
(4)������������ӵļ��鷽���������
(1)�����Ա���(���)�Ϳ�������(����)��Ӧ�������ᱵ�Ϳ�������(��ǿ�ᡢǿ��)�����ӷ�ӦΪBa2++SO![]() =BaSO4�������������Ļ�ѧ��Ӧ�磺BaCl2+H2SO4=BaSO4��+2HCl��Ba(OH)2+Na2SO4=BaSO4��+2NaOH��BaCl2+Na2SO4=BaSO4��+2NaCl�ȣ��ʴ�Ϊ��BaCl2+Na2SO4=BaSO4��+2NaCl (��BaCl2+H2SO4=BaSO4��+2HCl��Ba(OH)2+Na2SO4=BaSO4��+2NaOH)��
=BaSO4�������������Ļ�ѧ��Ӧ�磺BaCl2+H2SO4=BaSO4��+2HCl��Ba(OH)2+Na2SO4=BaSO4��+2NaOH��BaCl2+Na2SO4=BaSO4��+2NaCl�ȣ��ʴ�Ϊ��BaCl2+Na2SO4=BaSO4��+2NaCl (��BaCl2+H2SO4=BaSO4��+2HCl��Ba(OH)2+Na2SO4=BaSO4��+2NaOH)��
(2) ��Ӧ2Na + O2 ![]() Na2O2��NaԪ����0�����ߵ�+1�ۣ������������Na2O2���������Na2O2����Ԫ�ػ��ϼ���+1�����ݻ�������Ԫ�ػ��ϼ۴�����Ϊ���֪��OԪ�صĻ��ϼ���-1���ʴ�Ϊ��Na2O2��-1��
Na2O2��NaԪ����0�����ߵ�+1�ۣ������������Na2O2���������Na2O2����Ԫ�ػ��ϼ���+1�����ݻ�������Ԫ�ػ��ϼ۴�����Ϊ���֪��OԪ�صĻ��ϼ���-1���ʴ�Ϊ��Na2O2��-1��
(3)ά����C�ܹ���Fe3+ת��Ϊ�����յ�Fe2+��FeԪ�صĻ��ϼ۽��ͣ�����ԭ��˵��ά����C���л�ԭ�ԣ��ʴ�Ϊ����ԭ�ԣ�
(4) ̼�ᱵ�����ᱵ��������ˮ����̼�ᱵ�ܹ�������������ᣬ���ᱵ���ܣ����Ϊ�˼��������Ƿ��������Σ�����ȡ�������������ˮ�������м���ϡ���ᣬ��ȥ̼���Σ�Ȼ���ټ����Ȼ�����Һ�����ɰ�ɫ������˵���û�����к��������Σ��ʴ�Ϊ��ϡ����Ȼ�����


 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 0.50molL��1NaOH��Һ10.00mL����δ֪Ũ�ȵ�����20.00mLǡ�õζ����յ㣬����˵����ȷ���ǣ�������
A. ���ζ���ϣ��ζ��ܼ�������һ��Һ�壬�����������Ũ��ƫ��
B. ����Ͳ��ȡ��������
C. ��ѡ�÷�̪��ָʾ�����յ�ʱ��Һ��ǡ����ɫ
D. �����Ũ��Ϊ1.00 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���dz��Ը���Ϊԭ�����ǣ�ͬʱ�õ������ĸ��������Ը����������ۺ����ò�����������ۺ�Ч�棬���һ��ܷ�ֹ������Ⱦ������������ͼ��
��֪:ʯ���ѽ��ѳ�Ϊ����H����Ҫ������G�Ǿ�����ζ��Һ�塣�ش��������⣺
(1)H�еĹ���������Ϊ____________;E������Ϊ____________��
(2)H��D�Ļ�ѧ��Ӧ����Ϊ____________��
(3)ʵ�������Ʊ�G�ķ�Ӧװ����ͼ��ʾ��
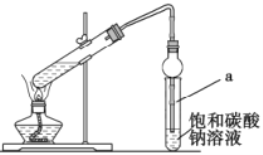
����̲��в��õ�ʵ��װ�ò�ͬ����װ���в��������θ���ܣ���������____________������̼������Һ������____________��
��ʵ���������Ҫ�����Թ�a�е�G��Ҫ�õ�����Ҫ����������____________���ձ���
����ʵ�����ú�18O��D��F��Ӧ��F��G�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ӵ��Ӧ�úܹ㡣ij������Ӷ��ε�صĵ缫������Ҫ������ﮣ�LiCoO2����ʯī������һ��ϡ�еĹ��ؽ������Ͼ�����ӵ�ص缫���ϵĻ������������ش�
��1������ӵ�أ��ֳ������Ũ���أ��Ĺ���ԭ����
��.�����̣�Li+�Ӻ�LiCoO2�ĵ缫���ѳ���������Co����������ʱ�ü�����ƶ�̬��Li1-xCoO2����
��.�ŵ����ԭ��ʾ��ͼ��ͼ��ʾ��
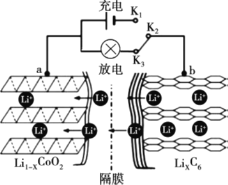
�� �ŵ�ʱ�����ӵ���������Ϊ______������a��b��K2��K3��
�� �ŵ�ʱ�������ĵ缫��ӦʽΪ______��
��2������﮻��������������£�
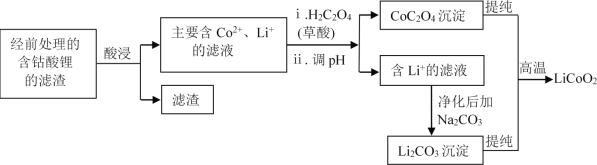
�� ��H2SO4���ʱ��ͨ������30%��H2O2����߽���Ч�ʣ�����H2O2��������______��
�� ���������H2SO4��H2O2������Ч��Ҳ�ܸߣ�����ҵ�ϲ�ʹ�����ᡣ��Ҫԭ���ǣ�
��.������ж�������Ⱦ�����塣д����Ӧ��Ӧ�Ļ�ѧ����ʽ_______��
��.Cl���Խ������ϵĸ�ʴ��������ˮ������ȡ�
�� ������������ʱ����ͬ��Ӧʱ�䣬�����¶����ߣ�������﮵Ĺ���������H2SO4��30% H2O2 ���Һ�еĽ�����������ͼ������������¶����ߣ��ܵĽ����������ߺ͵�ԭ��______��
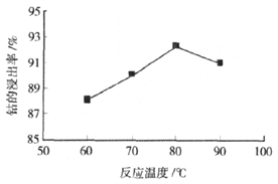
�� ��֪����Ϊ��Ԫ���ᣬӦ�û�ѧƽ���ƶ�ԭ������ϻ�ѧ�������CoC2O4������ͬʱ��Һ������ǿ��ԭ��______��
�� �����£���O2����ʱ������CoC2O4��Li2CO3����ΪLiCoO2�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����������������������ȷ���� �� ��
A. ��״���£�22.4LH2O���еķ�����Ϊ1 NA
B. ���³�ѹ�£�16g O2���е�ԭ����Ϊ1 NA
C. ͨ��״���£�1NA ��SO2����ռ�е����ԼΪ22.4L
D. ���ʵ���Ũ��Ϊ0.5mol/L��K2SO4��Һ�У�����SO42������Ϊ0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪABC����ʵ��װ�á�
A��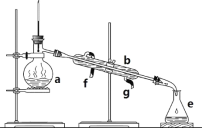 B��
B�� 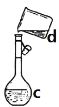 C��
C�� 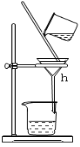
(1)д���������������ƣ�b.___�� c._____��h.____��
(2)����a��e�У�ʹ��ǰ�������Ƿ�©ˮ����_____��(�����)
(3)������װ�÷���ƾ���ˮ�Ļ�����ȱ�ٵ�������_____���������������������ʵ�飬����ˮ��____������(��f��g)��
(4)��������0.1mol/LNaOH��Һ450mL��Bװ����ijͬѧת����Һ��ʾ��ͼ��
�� B ͼ�еĴ�����_____��
�� ���ݼ����֪������NaOH������Ϊ_______��
�� ����ʱ������ȷ�IJ���˳����(��ĸ��ʾ��ÿ����ĸֻ����һ��)________��
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ
B��ȷ��ȡ���������������ƹ������ձ��У��ټ�������ˮ(Լ30mL)���ò���������������ʹ�����ܽ�
C�����ܽ������������Һ�ز�����ע��500mL������ƿ��
D��������ƿ�ǽ�����ҡ��
E������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�2��3cm��
F�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
(5)�����������������������ҺŨ�Ƚ��к�Ӱ��(����ƫ��������ƫ����������Ӱ����)����û�н���A����_______������ƿ������ϴ�Ӻ������������ˮ_________��������ʱ���ӿ̶���_______��
(6)��(4)������Һ����ʢ������ͭ��Һ�Թ��У����Թ۲쵽������_____��������Ӧ�����ӷ���ʽΪ_______�������õ��������з��룬��ѡ�÷��뷽����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.1 mol��L-1 NaOH��Һ�ζ�20 mL 0.1 mol��L-1 HX��Һ����Һ��pH�����NaOH��Һ����仯��ͼ������˵������ȷ����

A. HX����
B. V1 ��20
C. M����Һ������Ũ���ɴ�С��˳��Ϊ��c(X��)��c(Na��)��c(H��)��c(OH��)
D. ���ߵ�������ʱ��c(Na��)��c(X��) + c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա�������CO2��CH4ת��Ϊ�߸���ֵ��ƷCH3COOH�Ĵ���Ӧ���̡�������ʾ��ͼ���¡�

����˵������ȷ����
A. ����CH3COOH�ܷ�Ӧ��ԭ��������Ϊ100%
B. CH4��CH3COOH����������C�DH����������
C. �١����ų��������γ���C�DC��
D. �ô�������Ч��߷�Ӧ���ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
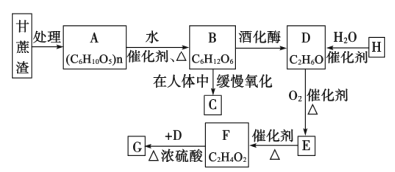
����Ŀ����֪A��һ����Ҫ�Ļ�������ԭ�ϣ��������̼Ԫ�صİٷֺ���Ϊ85.7%������Է�����С��30��A��B��C��D��E��F��G��H����ͼ��ʾ��ת����ϵ�����ֲ�������ȥ��������BΪ�߷��ӻ����CΪ��ɫ��ζ���壬ʵ�����п���ͨ��G�����ʯ��ȡ��DΪ��������ʹ���Ը��������Һ��ɫ��E��GΪ�����г������л����E��������ζ��H����ζ��
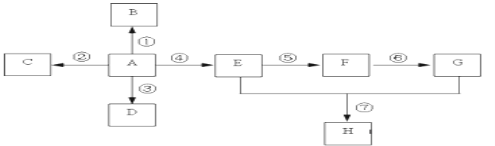
��1��д�����и����ʵĹ����ŵ����ƣ�A ___________��E ___________��
��2����Ҫ��д�����и����仯�Ļ�ѧ����ʽ
��Ӧ��__________________��
��Ӧ��_____________________��
��Ӧ�� _______________________��
��3��д�����з�Ӧ���ͣ���Ӧ��___________����Ӧ��___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com