
| A、1mol/L |
| B、2mol/L |
| C、2.5mol/L |
| D、3mol/L |
| 2.24L |
| 22.4L/mol |
| 0.2mol |
| 0.1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
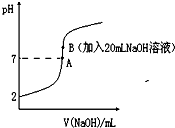 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示.| n(已电离的弱电解质) |
| n(全部的弱电解质) |
| c(H+)?c(F-) |
| c(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
| B、某物质在固态时能导电,可确认该物质是金属单质 |
| C、一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态 |
| D、氧化物只可能是氧化产物,不可能是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+,K+,NO3-,Cl- |
| B、Na+,H+,NO3-,SO42- |
| C、K+,Ca2+,NO3-,CO32- |
| D、Cu2+,Ba2+,Cl-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2和SO2中物质的量比为1:1 |
| B、CO2和SO2的密度比为1:1 |
| C、CO2和SO2的物质的量浓度比为11:16 |
| D、CO2和SO2中所含氧原子个数比为16:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤⑥ | B、①③⑤ |
| C、②④⑦ | D、①③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种难溶物中溶解度小的物质其KSP不一定小 |
| B、同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C、因为Ksp(BaSO4)=1.08×l0-10,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D、相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1?L-1盐酸、②0.1mo1?L-1氯化镁溶液、③0.1mo1?L-1硝酸银溶液中,c(Ag+):③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com