
【题目】![]() 是一种重要的化工原料,其有关制备途径及性质如图所示下列说法正确的是
是一种重要的化工原料,其有关制备途径及性质如图所示下列说法正确的是
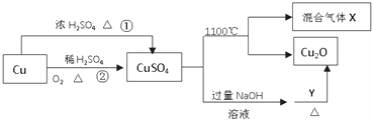
A. 相对于途径①,途径②更好地体现了绿色化学思想
B. 加Y加热过程中,Y被还原
C. CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体。
D. 将CuSO4溶液蒸干,可制得胆矾晶体
【答案】A
【解析】
A. 相对于途径①,铜和浓硫酸反应会生成二氧化硫气体污染空气,途径②的优点:制取等质量胆矾需要的硫酸少、途径②无污染性气体产生,更好地体现了绿色化学思想,所以A选项是正确的;
B. 由Cu(OH)2到Cu2O,铜元素化合价降低,被还原,则Y具有还原性,被氧化,故B错误;
C.硫酸铜分解生成Cu2O与氧气、SO3、SO2,根据2CuSO4═Cu2O+ SO2↑+ SO3↑+ O2↑知,X可能是O2、SO2和SO3的混合气体,若只是二氧化硫和三氧化硫,铜元素、硫元素化合价只有降低,无元素化合价升高,故C错误;
D. 将CuSO4溶液蒸干,会导致开始得到的胆矾晶体失去结晶水,故D错误。
故答案选A。


科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
![]()
已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有_________________。
②写出氧化过程中的离子方程式:________。
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是__________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是______(填选项序号)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定________和__________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作(按操作先后顺序列出) ______________(填序号)。
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是
( )。
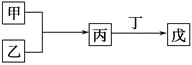
A. 若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸
B. 若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸
C. 若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2
D. 若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
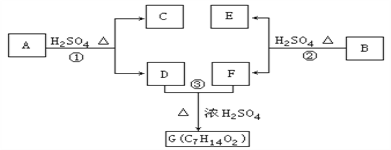
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为__________________;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为_____________,D具有的官能团是________________;
(3)反应①的化学方程式是_____________________________;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是______________________________;
(5)E可能的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)26H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:(已知:FeS2与H2SO4不反应)

(1)莫尔盐属于____________。
A、酸式盐 B、碱式盐 C、复盐 D、硫酸盐
(2)硫铁矿焙烧的主反应是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有__________,若150kg硫铁矿(FeS2质量分数为80%)完全反应转移电子数为________________________
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有__________,若150kg硫铁矿(FeS2质量分数为80%)完全反应转移电子数为________________________
(3)加H2SO4酸浸,发生反应的离子方程式为________________________________。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ的离子方程式为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反应Ⅱ的离子方程式为:_________________________________。
(5)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中,_______________证明含有Fe2+和NH4+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物。合成其的两种中间体及羟甲香豆素的结构如下:
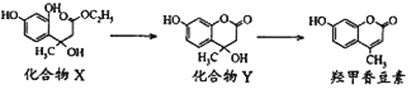
下列有关说法正确的是
A. 化合物X和Y分子各含有2个手性碳原子
B. 化合物Y能发生加成反应、取代反应和消去反应
C. lmol 羟甲香豆素最多可与2moINaOH反应
D. 化合物X和羟甲香豆素分别与溴水反应,最多消耗的Br2的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
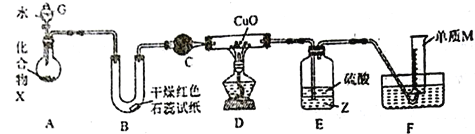
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中含组成单质M的元素质量分数为16.9%,写出X与水反应的化学方程式:_____________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D中固体颜色发生变化):__________________________________________________。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。

请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________________________。沉淀E与稀硫酸反应的离子方程式为__________________________________________。溶液G与过量稀氨水反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水与久置的氯水相比较,下列结论不正确的是
A. 颜色相同B. 前者能使有色布条褪色
C. 都含有H+D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com