
【题目】羟甲香豆素是一种治疗胆结石的药物。合成其的两种中间体及羟甲香豆素的结构如下:
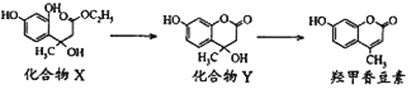
下列有关说法正确的是
A. 化合物X和Y分子各含有2个手性碳原子
B. 化合物Y能发生加成反应、取代反应和消去反应
C. lmol 羟甲香豆素最多可与2moINaOH反应
D. 化合物X和羟甲香豆素分别与溴水反应,最多消耗的Br2的物质的量之比为1:1
科目:高中化学 来源: 题型:
【题目】铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。

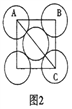
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为acm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含a、M、NA的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
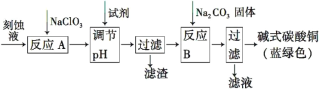
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,其有关制备途径及性质如图所示下列说法正确的是
是一种重要的化工原料,其有关制备途径及性质如图所示下列说法正确的是
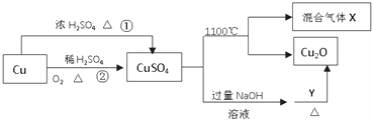
A. 相对于途径①,途径②更好地体现了绿色化学思想
B. 加Y加热过程中,Y被还原
C. CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体。
D. 将CuSO4溶液蒸干,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各物质按酸、碱、盐分类顺序排列,正确的是 ( )
A.盐酸、烧碱、胆矾B.硫酸、纯碱、食盐
C.碳酸、乙醇、醋酸钠D.磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.把100mL3mol·L-1的H2SO4跟100mL水混合,硫酸的物质的量浓度变为1.5 mol·L-1
B.把200mL3mol·L-1的BaCl2溶液跟100mL3mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol·L-1
C.把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D.1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的说法中正确的是( )
A.物质的量是表示物质质量的物理量
B.物质的量是表示物质多少的物理量
C.物质的量是含有一定数目粒子集合体的物理量
D.物质的量既可表示物质的质量又可表示物质的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁和无水氯化镁具有广泛用途。用白云石(CaCO3 MgCO3)为原料生产碱式碳酸镁和无水氯化镁的流程如下:
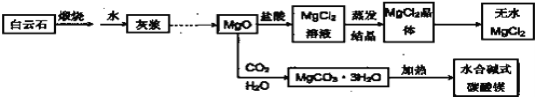
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有:_________________。
(2)为探究所制得的水合碱式碳酸镁(m MgCO3n Mg(OH)2 xH2O )的组成。某同学组装仪器如图所示:
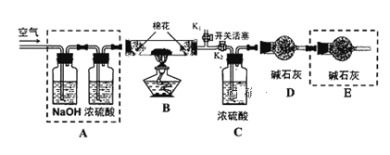
实验测得:硬质玻璃管中剩余的固体质量为1.60g,C处浓H2SO4增重0.72g,D处碱石灰增重1.32g,此水合碱式碳酸镁的化学式为:_______________________。
(3)A框中装置的作用是_____________________________________。
(4)在装好试剂后,加热前应进行的操作是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com