
����Ŀ������˵����ȷ����( )
A����100mL3mol��L��1��H2SO4��100mLˮ�������������ʵ���Ũ�ȱ�Ϊ1.5 mol��L��1
B����200mL3mol��L��1��BaCl2��Һ��100mL3mol��L��1��KCl��Һ��Ϻ�����Һ�е�c(Cl-)��Ȼ��3mol��L��1
C����100 g 20%��NaCl��Һ��100 g H2O��Ϻ���NaCl��Һ������������10%
D��1 L ˮ���ܽ� 0.2 mol ����أ�������� 0.2 mol/L �������Һ
���𰸡�C
��������
�����������100mL3mol��L��1��H2SO4��100mLˮ�������Ϻ���Һ���������200mL����������ʵ���Ũ�Ȳ���1.5 mol��L��1����A����3mol/L-1��BaCl2��Һ��������Ũ��Ϊ6mol/L��3mol/L-1��KCl��Һ��������Ũ��Ϊ3molL��������Ũ�Ƚ���3mol/L��6mol/L������������仯����Ϻ�������Ũ��ԼΪ![]() =5mol/L����B����Ϻ���Һ����Ϊ200g�������Ȼ��Ƶ���������Ϊ100g��20%=20g�����Ի�Ϻ�����������Һ��������Ϊ
=5mol/L����B����Ϻ���Һ����Ϊ200g�������Ȼ��Ƶ���������Ϊ100g��20%=20g�����Ի�Ϻ�����������Һ��������Ϊ![]() ��100%=10%����C��ȷ��1 L ˮ���ܽ� 0.2 mol ����أ�������Һ���������1L���������Һ��Ũ�Ȳ���0.2 mol/L����D������
��100%=10%����C��ȷ��1 L ˮ���ܽ� 0.2 mol ����أ�������Һ���������1L���������Һ��Ũ�Ȳ���0.2 mol/L����D������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�NO��NH3���Է�����Ӧ����N2��H2O������NO��NH3�Ļ����1mol����ַ�Ӧ�����ò����У�������ԭ�õ���N2�Ⱦ������õ���N2��1.4g��
��1��д����Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ��
��2�������Ϸ�Ӧ������ȫ���Լ���ԭ��Ӧ�������NO��NH3�����ʵ������ܸ��Ƕ��١�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��BΪ������ͬ���������Ԫ�أ���A��ԭ������Ϊn����B��ԭ������������Ϊ��������
A.n+16
B.n+2
C.n+8
D.n+10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�͵���( )
������ƽ(ʹ������)����ʱ�����������������λ�÷ŵߵ��� ����Һת�Ƶ�����ƿ���ձ���������δ������ˮϴ�� ��ת����Һǰ����ƿ������������ˮ ������ʱ����������ƿ�Ŀ̶��� �����ݺ�ҡ�ȣ�����Һ�潵�ͣ��ֲ�������ˮ�����´ﵽ�̶���
A. �٢ڢ� B. �٢ۢ� C. �ۢܢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҷ�к��ж������������彡�����л��ɷּ��ơ�����������Ԫ�أ�ij��ѧ�о���ѧϰС����Ʒ����ⶨijƷ�Ʋ�Ҷ�и�Ԫ�ص�������������������Ԫ�صĴ��ڣ���֪CaC2O4Ϊ��ɫ����������������ȡ200g��Ҷ��Ʒ���յûҷۺ������ͼ������

��ش������й����⣺
��1������������ʾ��ijЩ�������ӵ�����������ȫ������pHΪ��
���� | Ca2+ | Fe3+ |
��ȫ����ʱ��pH | 13 | 4.1 |
ʵ��ǰҪ�Ƚ���Ҷ��Ʒ�������ճɻҷۣ�����ҪĿ�� ��
��2��д������ҺA������D�����ӷ�Ӧ����ʽ ��
��3��Ϊ��֤ʵ�龫ȷ�ȣ�����D��E��Ҫ�ֱ�ϴ�ӣ�����ϴ��Һת�ƻ�ĸҺ�У��ж�D�Ѿ�������ȫ������ ��
��4����KMnO4����Һ�ζ�C��Һʱ�������ķ�ӦΪ��5C2O42��+2MnO4��+16H+�T10CO2��+2Mn2++8H2O��
�ֽ���ҺCϡ����500mL����ȡ���е�25.00mL��Һ���������ữ����0.1000molL��1��KMnO4����Һ�ζ����յ�ʱ����KMnO4��Һ10.00mL��

A B C D
ͼ1 ͼ2
�� �˲�����������KMnO4����ҺӦװ��ͼ2���ĸ������У���д��ĸ�� ��
���ζ����յ㣬���� �����ú���ͼ3������ȡKMnO4����Һ�Ŀ̶����ݣ���ⶨ�ĸ�Ԫ�غ����� ���ƫ�ߡ���ƫ�͡�����Ӱ�족����
��5��ԭ��Ҷ�и�Ԫ�ص���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳƷ�����Ӧ������ζ����ʴ�Լ������Ѻá�����˵����������
A���轺������ʳƷ�����
B��P2O5��������ʳƷ�����
C����ˮ���Ȼ��ƿ�����ʳƷ�����
D���ӹ��������ˮ�Ե�ֲ����ά������ʳƷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ����ӵ�����(NA)��˵���������(����)
A��32 g O2������ԭ����ĿΪNA
B��0.5 mol H2O���е�ԭ����ĿΪ1. 5NA
C��1 mol H2O���е�H2O������ĿΪNA
D��0.5NA���������ӵ����ʵ�����0.5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mLijŨ�ȵ���������μ���0.1 mol/L�İ�ˮ����ҺpH�ı仯����백ˮ�������ϵ��ͼ��ʾ��
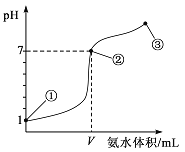
����������ȷ����
A. ��������ʵ���Ũ��Ϊl mol/L
B. ��������֮�������һ�㣺c(Cl-)��c(NH4+)��c(H+)��c(OH-)
C. �ڵ�����ʾ��Һ�У�c(NH4+)=c(Cl-)��c(OH-)=c(H+)����V<20
D. �ڵ�����ʾ��Һ�У���ˮ�������c(OH-)>l0-7mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com