
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:
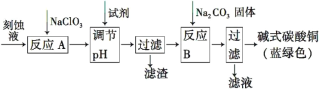
查阅资料知,通过调节溶液的酸碱性可使Cu2+,Fe2+,Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 4.7 | 7.5 | 1.4 |
沉淀完全pH | 6.7 | 14 | 3.7 |
(1)氯酸钠的作用是______________________________________。
(2)调节反应A所得溶液的pH范围为_______________________,
可以选择的试剂是______(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碱式碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是________;若温度过高,所得蓝绿色沉淀中会有黑色固体出现,黑色固体可能是________。
(4)已知滤液中含有碳酸氢钠,写出生成碱式碳酸铜的离子方程式:______________________________________________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净____________________。
【答案】将Fe2+氧化为Fe3+3.7~4.7c、d水浴加热CuO2Cu2++3CO32-+2H2O====Cu2(OH)2CO3+2HCO3-取最后一次洗涤液,加入硝酸银、稀硝酸溶液,无沉淀产生则表明已洗净
【解析】
(1)利用NaClO3的强氧化性,将Fe2+氧化成Fe3+;(2)根据表格中的数据,Fe3+全部以Fe(OH)3形式沉淀出来,Cu2+不能转化成沉淀;(3)控制温度为60℃时,一般采用水浴加热;(4)利用CO32-的水解,进行判断;(5)注意产品表面的杂质。
(1)根据金属阳离子生成沉淀的pH,要除去Fe2+、Fe3+杂质,必须先将Fe2+转变为Fe3+,再调节pH,故NaClO3的作用是将Fe2+转变为Fe3+;
(2)要将Fe3+完全沉淀,但不能将Cu2+沉淀,故pH应在3.7~4.7。除杂时,不能引入新的杂质,同时促进Fe3+的水解,a、加入氨水,引入NH4+,故a错误;b、加入硫酸铜,引入SO42-,故b错误;c、加入氢氧化铜,因为氢氧化铜是难溶碱,因此不能引入新杂质,且能够调节pH,故c正确;d、加入碱式碳酸铜,碱式碳酸铜不溶于水,不引入新的杂质,且能够调节pH,故d正确;
(3)控制反应温度在100℃以下,可采用水浴加热法;碱式碳酸铜受热易分解成黑色的CuO;
(4)由信息知,反应物中有Cu2+、CO32-生成物中有碱式碳酸铜,再根据原子守恒和电荷守恒,反应的离子方程式为2Cu2++3CO32-+2H2O====Cu2(OH)2CO3+2HCO3-;
(5)沉淀上会吸附Na+、Cl-等,故可检验Cl-。注意一定要强调“最后一次”,具体操作是取最后一次洗涤液,加入硝酸银、稀硝酸溶液,无沉淀产生则表明已洗净。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q;x、y、z是由这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01mol·L-lw溶液中,![]() =1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
=1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
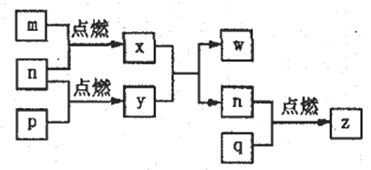
A. 原子半径的大小:a<b<c<d
B. 简单氢化物的沸点:b>d
C. y的电子式:![]()
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系。下列判断不正确的是( )
A. 若反应过程中消耗1 mol氯气,则1 mol<转移电子数<![]() mol
mol
B. 反应停止后n(NaClO)∶n(NaCl)∶n(NaClO3)(物质的量之比)可能为1∶11∶2
C. 反应过程中消耗氯气与NaOH的物质的量之比为1∶2
D. 氧化产物为NaClO和NaClO3,反应过程中n(NaClO)∶n(NaClO3)为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
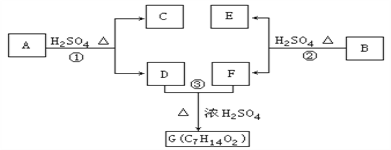
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为__________________;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为_____________,D具有的官能团是________________;
(3)反应①的化学方程式是_____________________________;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是______________________________;
(5)E可能的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的一个生产工艺流程如图所示,下列叙述正确的是( )
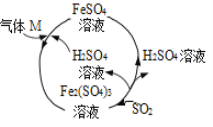
A. 该工艺流程的目的是制备 Fe2(SO4)3
B. 气体 M一定是 SO3
C. 气体 M 参加的反应是化合反应
D. SO2 参加反应时氧化剂和还原剂的物质的量之比是 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物。合成其的两种中间体及羟甲香豆素的结构如下:
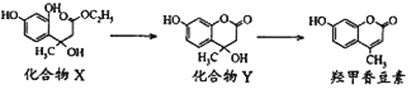
下列有关说法正确的是
A. 化合物X和Y分子各含有2个手性碳原子
B. 化合物Y能发生加成反应、取代反应和消去反应
C. lmol 羟甲香豆素最多可与2moINaOH反应
D. 化合物X和羟甲香豆素分别与溴水反应,最多消耗的Br2的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验最终能看到白色沉淀的是( )
A.二氧化碳或二氧化硫通入氯化钙溶液中
B.过量二氧化碳通入澄清石灰水中
C.过量二氧化硫通入氢氧化钡溶液中
D.过量二氧化碳通入硅酸钠溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 该烃属于苯的同系物
B. 所有原子可能都在同一平面上
C. 最多可能有9个碳原子在同一平面
D. 可能有5个碳原子在同一直线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com