
����Ŀ����֪������NaOH��Һ��Ӧ������NaCl��NaClO��NaClO3��NaClO�ڼ��������·ֽ�����NaCl��NaClO3����������������Һ��ͨ��һ��������������������ʱ�����Һ���γɻ����ϵ�������жϲ���ȷ����(����)
A. ����Ӧ����������1 mol��������1 mol��ת�Ƶ�������![]() mol
mol
B. ��Ӧֹͣ��n(NaClO)��n(NaCl)��n(NaClO3)(���ʵ���֮��)����Ϊ1��11��2
C. ��Ӧ����������������NaOH�����ʵ���֮��Ϊ1��2
D. ��������ΪNaClO��NaClO3����Ӧ������n(NaClO)��n(NaClO3)Ϊ1��1
���𰸡�D
��������A����amol�������뷴Ӧ��������Ӧ�У�Cl2+2NaOH=NaCl+NaClO+H2O��3Cl2+6NaOH=5NaCl+NaClO3+3H2O������������ֻ��NaClO��ת�Ƶ��������٣�Ϊamol��2��![]() ��1=amol����������ֻ��NaClO3��ת�Ƶ�������࣬Ϊamol��2��
��1=amol����������ֻ��NaClO3��ת�Ƶ�������࣬Ϊamol��2��![]() ��1=
��1=![]() mol�����Է�Ӧת�Ƶ���Ϊ��amol��ת�Ƶ�������
mol�����Է�Ӧת�Ƶ���Ϊ��amol��ת�Ƶ�������![]() mol����A��ȷ��B����n(NaCl)=11mol��n(NaClO)=1mol��n(NaClO3)=2mol������NaCl��õĵ���Ϊ��11mol��1=11mol������NaClO��NaClO3ʧȥ�ĵ���Ϊ1mol��1+2mol��5=11mol����ʧ������ȣ��ʷ�Ӧ��ϵ��n(NaClO)��n(NaCl)��n(NaClO3)(���ʵ���֮��)����Ϊ1��11��2����B��ȷ��C������NaCl��NaClO��NaClO3��֪�������Ӻ���ԭ�ӵ����ʵ���֮��Ϊ1��1����μӷ�Ӧ����������NaOH�����ʵ���֮��Ϊ1��2����C��ȷ��D�����ݻ��ϼ۱仯��֪����Ӧ��NaC1O��NaClO3Ϊ�������������ȱ�����ݣ���������ߵ����ʵ���֮�ȣ���D����ѡD��
mol����A��ȷ��B����n(NaCl)=11mol��n(NaClO)=1mol��n(NaClO3)=2mol������NaCl��õĵ���Ϊ��11mol��1=11mol������NaClO��NaClO3ʧȥ�ĵ���Ϊ1mol��1+2mol��5=11mol����ʧ������ȣ��ʷ�Ӧ��ϵ��n(NaClO)��n(NaCl)��n(NaClO3)(���ʵ���֮��)����Ϊ1��11��2����B��ȷ��C������NaCl��NaClO��NaClO3��֪�������Ӻ���ԭ�ӵ����ʵ���֮��Ϊ1��1����μӷ�Ӧ����������NaOH�����ʵ���֮��Ϊ1��2����C��ȷ��D�����ݻ��ϼ۱仯��֪����Ӧ��NaC1O��NaClO3Ϊ�������������ȱ�����ݣ���������ߵ����ʵ���֮�ȣ���D����ѡD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��һ�������£���Ӧ X(g)+3Y(g![]() 2Z(g) ��H=-a kJ/mol(a>0 )��ijʵ��С����X��ת����(��)�ڲ�ͬ�¶���ѹǿ��P)�� ��ʵ�����ݣ�����֮���ϵ����ͼ��ʾ������˵����ȷ����
2Z(g) ��H=-a kJ/mol(a>0 )��ijʵ��С����X��ת����(��)�ڲ�ͬ�¶���ѹǿ��P)�� ��ʵ�����ݣ�����֮���ϵ����ͼ��ʾ������˵����ȷ����

A. ͼ��a��b�����Ӧ��ƽ�ⳣ�����
B. ������Ӧ�ڴﵽƽ�����С�����Y��ת�������
C. �����¶ȣ������淴Ӧ��������ƽ��������Ӧ�����ƶ�
D. ��2.0molX��6.0molY�������ܱ������з�����Ӧ���ų�������Ϊ2akJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����A��B�����2 L���ܱ������У��������·�Ӧ��
3A(g)��B(g)![]() xC(g)��2D(g)����5 min���D��Ũ��Ϊ0.5 mol/L��c(A)��c(B)��3��5��C��ƽ����Ӧ����Ϊ0.1 mol/(L��min)����
xC(g)��2D(g)����5 min���D��Ũ��Ϊ0.5 mol/L��c(A)��c(B)��3��5��C��ƽ����Ӧ����Ϊ0.1 mol/(L��min)����
��1����ʱA��Ũ��c(A)��________mol/L����Ӧ��ʼǰ�����е�A��B�����ʵ�����n(A)��n(B)��________mol��
��2��ǰ5 min����B��ʾ��ƽ����Ӧ����v(B)��________mol/(L��min)��
��3����ѧ��Ӧ����ʽ��x��ֵΪ________��
��4��5 minʱ����A��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ҫ����1mol/L��ϡ����250mL���ش��������⣺
��1����Ҫ98%�ܶ�Ϊ1.84g/cm3��Ũ����_______mL��
��2������ʱ������ʹ�õ�������_______�����ţ���
���ձ� ��100mL��Ͳ ��20mL��Ͳ ��1000mL����ƿ �� ��ͷ�ι� ��������ƽ�������룩 ������������ȱ�ٵ�������___________��
��3�����ƹ����г��������������������ҺŨ���к�Ӱ�죨����ƫ������ƫ��������Ӱ��������
����Һδ��ȴ�����¾�ת�Ƶ�����ƿ��________��
�������ˮ�����˿̶��ߣ��ý�ͷ�ι��������ಿ�֣�ʹҺ��ǡ�õ��̶��ߣ�_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
����Ҫ���ȷ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
����ѧ��Ӧ�ķ���һ������������仯
����Ӧ�Ƿ��Ȼ������ȱ��뿴��Ӧ��������������е�����������Դ�С
���ɻ�ѧ���Ķ���˵��-һ�������˻�ѧ��Ӧ
A. �ۢ� B. �٢� C. �ڢ� D. �ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij��ɫ����Һ�п��ܴ�������Ag+��Mg2+��Cu2+�еļ������ӡ�
��1�������κ�ʵ��Ϳ��Կ϶�ԭ��Һ�в����ڵ�������________��
��2��ȡ����ԭ��Һ�������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��ɫ��������ʧ��ԭ��Һ�п϶��е�������_______�����ӷ�Ӧ����ʽΪ____________________��
��3��ȡ��2������Һ�������NaOH�����ְ�ɫ������˵��ԭ��Һ�п϶����ڵ�������______________��
��4��ԭ��Һ�п��ܴ������ڵ�������������A��D�е����������________��
A��Cl- B��NO3- C��CO32- D��OH-
������1����CuCl2��Һ�еμ�NaOH��Һ������________�����ӷ���ʽ��______________��
��2����NaHCO3��Һ�еμ�ϡ���ᣬ����________�����ӷ���ʽ��______________________��
��3��ϡ�����KOH��Һ��ϣ�����________�����ӷ���ʽ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����ʵ����������Ӧ������ȷ���� �� ��
ѡ�� | ʵ����ʵ | ���� |
A | ����������ͬ��Na2S2O3��ҺŨ��Խ���������������ʱ��Խ�� | ��������������ʱ������Ӧ��Ũ�Ȼ�ѧ��Ӧ���ʼӿ� |
B | �ڻ�ѧ��Ӧǰ�����������ͻ�ѧ���ʶ�û�з����ı� | ����һ�������뻯ѧ��Ӧ |
C | ���ʵ���Ũ����ͬ������ʹ���ֱ������������״��ͬ��п����Ӧ | ��Ӧ��ʼ������ͬ |
D | ���ݻ��ɱ���ܱ������з�����ӦH2(g)+I2(g) | ����Ӧ���ʼӿ죬�淴Ӧ���ʲ��� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ����˵���д�����ǣ� ��
A. �Ȼ����ۻ����Ȼ�������ˮʱ��Ҫ�ƻ���ѧ��
B. ���ӻ������п��ܺ��й��ۼ������ۻ�������һ�����������Ӽ�
C. �Ȼ�����ȱ�����壬��ȴ���ֳɾ��壬�˹����л�ѧ��û�з����仯
D. �⾧�������ͱ��ۻ�ʱ��δ�漰��ѧ���ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼס��ҡ������������л����˵����ȷ����
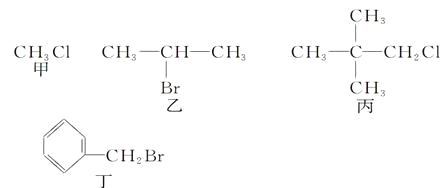
A. �ס��ҡ��������зֱ������ˮ�����к���ɫҺ������
B. �ס��ҡ��������м���NaOH��Һ���ȣ�Ȼ�����ϡ���������Һ�����ԣ��ٵ���AgNO3��Һ�����г�������
C. �ס��ҡ��������м���NaOH�Ĵ���Һ���ȣ�Ȼ�����ϡ���������Һ�����ԣ��ٵ���AgNO3��Һ�����г�������
D. �ҷ�����ȥ��Ӧ�õ�����ϩ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com