
【题目】Ⅰ.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,原溶液中肯定有的离子是_______,离子反应方程式为____________________。
(3)取(2)的滤液加入过量NaOH,出现白色沉淀,说明原溶液中肯定存在的离子有______________。
(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)________。
A.Cl- B.NO3- C.CO32- D.OH-
Ⅱ.(1)向CuCl2溶液中滴加NaOH溶液,现象:________,离子方程式:______________;
(2)向NaHCO3溶液中滴加稀硫酸,现象:________,离子方程式:______________________;
(3)稀硝酸和KOH溶液混合,现象:________,离子方程式:__________________________。
【答案】 Cu2+ Ag+ Ag++Cl-===AgCl↓ Mg2+ B 生成蓝色沉淀 Cu2++2OH-===Cu(OH)2↓ 生成无色无味气体 HCO![]() +H+===CO2↑+H2O 无明显现象 H++OH-===H2O
+H+===CO2↑+H2O 无明显现象 H++OH-===H2O
【解析】Ⅰ.(1). Cu2+为有色离子,无色透明溶液中不存在有色的离子,所以原溶液中一定不存在Cu2+,故答案为:Cu2+;
(2).取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有Ag+,反应的离子方程式为Ag++Cl-═AgCl↓,故答案为:Ag+;Ag++Cl-=AgCl↓;
(3).取(2)中的滤液,因在上步中已经通过加入过量的稀盐酸除去Ag+,则在没有Ag+的溶液中,加入过量NaOH,出现白色沉淀,则原溶液中一定存在Mg2+,故答案为:Mg2+;
(4).由以上分析可知,溶液中含有的阳离子为Ag+、Mg2+,Ag+与Cl-、CO32-、OH-不共存,所以没有Cl-、CO32-、OH-,则阴离子只能是NO3-,故答案为:B。
Ⅱ.(1)向CuCl2溶液中滴加NaOH溶液,二者反应生成蓝色的氢氧化铜沉淀和氯化钠,反应的离子方程式是:Cu2++2OH-===Cu(OH)2↓,故答案是:生成蓝色沉淀;Cu2++2OH-===Cu(OH)2↓;
(2)向NaHCO3溶液中滴加稀硫酸,会反应生成无色无味的CO2气体,反应的离子方程式是:HCO3-+H+=CO2↑+H2O,故答案是:生成无色无味气体;HCO3-+H+=CO2↑+H2O;
(3)稀硝酸和KOH溶液混合,反应生成硝酸钾和水,既没有沉淀生成,也没有气体生成,更无颜色变化,所以二者的反应无明显现象,反应的离子方程式是:H++OH-===H2O,故答案是:无明显现象;H++OH-===H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁电池具有比能量高、无污染的特点,用下图模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是

A. 充电时,阳极上的电极反应式为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
B. 放电时,负极上的电极反应式为:Zn-2e-+2H2O=Zn(OH)2+2H+
C. 放电时,电子由正极通过外电路流向负极
D. 充电时,阴极区溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室中制备气体或验证气体性质的装置图

(1)发生装置A中制取氯气的化学方程式 .
(2)利用上图装置制备纯净的氯气,并证明氧化性:C12>Fe3+
则装置B中的溶液的作用是 ;装置D中加的最佳试剂是(填序号) :供选试剂:a.浓H2SO4b.FeCl2溶液 c.无水氯化钙 d.KSCN与FeCl2的混合溶液
(3)在图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的 (填溶液名称),E中加入 溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为 ;实验2不严谨之处应如何改进 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
A. 离子半径:Na+>N3->H+
B. 反应①和②都是氧化还原反应
C. 反应②每生成1 mol H2,转移的电子数为NA
D. Na3N和NaH与盐酸反应都只生成一种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系。下列判断不正确的是( )
A. 若反应过程中消耗1 mol氯气,则1 mol<转移电子数<![]() mol
mol
B. 反应停止后n(NaClO)∶n(NaCl)∶n(NaClO3)(物质的量之比)可能为1∶11∶2
C. 反应过程中消耗氯气与NaOH的物质的量之比为1∶2
D. 氧化产物为NaClO和NaClO3,反应过程中n(NaClO)∶n(NaClO3)为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeBr2和FeI2混合溶液中逐渐通入氯气,不可能发生的反应离子方程式是( )
A. 2I-+Cl2===I2+2Cl-
B. 2Fe2++2Br-+2I-+3Cl2===2Fe3++I2+Br2+6Cl-
C. 2Fe2++4Br-+2I-+4Cl2===2Fe3++I2+2Br2+8Cl-
D. 4Fe2++2Br-+2I-+4Cl2===4Fe3++I2+Br2+8Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH标准溶液的配制和标定时,需经过NaOH溶液的配制、基准物质H2C2O4·2H2O的称量以及用NaOH溶液滴定等操作。下列操作正确的是( )
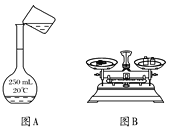
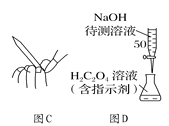
A. 用图A所示的方法转移NaOH溶液到容量瓶中
B. 用图B所示的装置准确称得0.15 g H2C2O4·2H2O
C. 用图C所示的操作排除碱式滴定管中的气泡
D. 用图D所示的装置,用NaOH待测液滴定H2C2O4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是
A. pH=6.5的溶液一定显酸性
B. 0.1mol L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol L-1
C. 常温下,等体积的0.2 mol L-1的盐酸与0.2 mol L-1的氢氧化钡溶液混合,所得溶液的pH=13
D. 常温下,某溶液中水电离出的c(OH-)=l×10-12 mol L-1,该溶液pH 一定等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁中含有C、N、Mn等元素,实验中常用过硫酸盐氧化法测定钢铁中锰的含量,反应原理为2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)Mn原子的价层电子的轨道衷达式(电子排布图)为______。
(2)已知H2S2O8的结构简式如图所示。
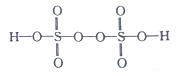
①H2S2O8中S的轨道杂化方式为______,H、O、S三种元素中,电负性最大的元素是_________(填元素符号)。
②S基态原子中电子的运动状态有_________种。
③上述反应中S2O82-断裂的共价键类型为________,(填“σ键”或“π键”) ,每生成1molMnO4-,断裂的共价键数目为_________NA。
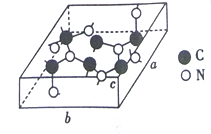
(3)C和N能形成多种结构的晶体。一种新型的超硬材料类似于金刚石的结构,但硬度比金刚石大,其晶胞如图所示(图示原子都包含在晶胞内),其化学式为________。已知晶胞参数a=0.64nm, b=0.55nm,c=0.24nm,则该晶体的密度为________(列出式子即可,但式子中不包含字母)g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com