
【题目】已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
A. 离子半径:Na+>N3->H+
B. 反应①和②都是氧化还原反应
C. 反应②每生成1 mol H2,转移的电子数为NA
D. Na3N和NaH与盐酸反应都只生成一种盐
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】关于碱金属元素的说法中正确的是
A. IA族元素都是碱金属元素
B. 碱金属单质可将铜从其盐溶液中置换出来
C. 金属钾具有强还原性,K+具有强氧化性
D. Cs常温下与水反应会发生爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CCl4的沸点低于SiCl4,其原因是晶体类型不同
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是共价化合物
C. HClO易分解是因为HClO分子间作用力弱
D. 离子化合物中不一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)浓盐酸中HCl的物质的量浓度为______________mol·L-1 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少 而变化的是(_______)。
A、溶液中HCl的物质的量 B、溶液的浓度
C、溶液中Cl-的数目 D、溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL 物质的量浓度为0.400mol·L-1的稀盐酸。
①学生需要量取_______mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
I、定容时俯视观察凹液面(________)
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(________)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸_______mL。
(2)配制时,必须使用的仪器有_______(填编号)。
①烧杯 ②100mL量筒 ③20mL量筒 ④1000mL容量瓶 ⑤ 胶头滴管 ⑥托盘天平(带砝码) ⑦玻璃棒,还缺少的仪器是___________。
(3)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”):
①溶液未冷却到室温就转移到容量瓶,________。
②如果加水超过了刻度线,用胶头滴管吸出多余部分,使液面恰好到刻度线,_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国拥有18000公里的大陆海岸线,海洋资源丰富,品种繁多。
(1)工业上利用海水制取溴单质,一般先用空气或水蒸气吹出卤水中的单质溴,再用SO2将其还原吸收。某研究性学习小组模拟上述过程提取溴,其装置如图所示:

①所用仪器的接口连接顺序是d→__________,e→b_______→f。
②A中发生反应的化学方程式为_____________________________________。
③溶液Z是______________________;C中仪器名称为______________________。
④你认为本实验的不足之处是____________________________________。
(2)某小组测定含溴卤水中溴元素的总量。
①该小组设计的实验方案:上述操作完成后,取C中溶液15.0 mL,加入适量HNO3溶液酸化,再加入足量AgNO3溶液,过滤,测定产生沉淀的质量。此方案不可行的主要原因是_________________(不考虑实验装置及操作失误的原因);
②请为该小组设计一个可行的实验方案_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,原溶液中肯定有的离子是_______,离子反应方程式为____________________。
(3)取(2)的滤液加入过量NaOH,出现白色沉淀,说明原溶液中肯定存在的离子有______________。
(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)________。
A.Cl- B.NO3- C.CO32- D.OH-
Ⅱ.(1)向CuCl2溶液中滴加NaOH溶液,现象:________,离子方程式:______________;
(2)向NaHCO3溶液中滴加稀硫酸,现象:________,离子方程式:______________________;
(3)稀硝酸和KOH溶液混合,现象:________,离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
铜镍合金曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)铜元素基态原子的电子排布式为_________,3d能级上的未成对电子数为_________。
(2)氢氧化铜与氨水作用形成[Cu(NH3)4](OH)2深蓝色溶液。
①[Cu(NH3)4](OH)2中阳离子的立体构型是_________。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为_______________,提供孤电子对的成键原子是_______________。
③氨可以形成的晶体属于_______晶体(填晶体类型),其结构中的氮原子只能形成_______个氮氢键,其原因是______________________________________。
(3)N原子的第一电离能IN=l402.3kJ/mol,0原子的第一电离能I0=1313.9kJ/mol。IN>I0的原因是_____________________________。
(4)单质铜及镍都是由__________键形成的晶体。
(5)铜镍合金的立方晶胞结构如图所示。

①晶胞中镍原子与铜原子的数量比为_______。
②若合金的密度为dg/cm3,晶体中任意―个Ni原子到最近Cu原子的距离为_______ cm(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是一种化工原料,有如下转化关系:

已知:

回答下列问题:
(1)A的名称(系统命名)是_____;B→C的反应类型是_________。
(2)B的结构简式是____,D的核磁共振氢谱共有________组峰。
(3)上述物质中互为同系物的是________________(填化合物代号)。
(4)F生成PHB的化学方程式是___________________
(5)E的同分异构体中,既能发生银镜反应,也能与碳酸氢钠溶液反应的共有________种(不考虑立体异构)。
(6)F除了合成PHB外,还可经过_________、酯化、聚合三步反应合成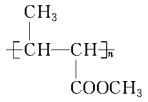 (一种类似有机玻璃的塑料)。在催化剂作用下,第三步反应的化学方程式是___________________。
(一种类似有机玻璃的塑料)。在催化剂作用下,第三步反应的化学方程式是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com