
����Ŀ������ѧ����ѡ��3:���ʽṹ�����ʡ�
ͭ���Ͻ�����Ҫ������ң������������������Ʒ���ش��������⣺
��1��ͭԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ_________��3d�ܼ��ϵ�δ�ɶԵ�����Ϊ_________��
��2��������ͭ�백ˮ�����γ�[Cu(NH3)4](OH)2����ɫ��Һ��
��[Cu(NH3)4](OH)2�������ӵ����幹����_________��
����[Cu(NH3)4]2+��Cu2+��NH3֮���γɵĻ�ѧ����Ϊ_______________���ṩ�µ��ӶԵijɼ�ԭ����_______________��
�۰������γɵľ�������_______���壨������ͣ�����ṹ�еĵ�ԭ��ֻ���γ�_______�����������ԭ����______________________________________��
��3��Nԭ�ӵĵ�һ������IN=l402.3kJ/mol��0ԭ�ӵĵ�һ������I0=1313.9kJ/mol��IN>I0��ԭ����_____________________________��
��4������ͭ����������__________���γɵľ��塣
��5��ͭ���Ͻ�����������ṹ��ͼ��ʾ��

�پ�������ԭ����ͭԭ�ӵ�������Ϊ_______��
�����Ͻ���ܶ�Ϊdg/cm3������������D��Niԭ�ӵ����Cuԭ�ӵľ���Ϊ_______ cm����NAΪ�����ӵ�������ֵ����
���𰸡� 1s22s22p63s23p63d104s1��[Ar]3d104s1 0 ���ı��� ��λ�� N ���� 3 ��ԭ��ֻ��3��δ�ɶԵ��� Nԭ�ӵ�2p�Dz㣨2p3��Ϊ�����������ع����Dz�����ڰ�����ȫ����ȫ��ʱԭ�ӵ������ή�ͣ����ȶ���ʧ���ӽ��ѣ�����������Ҳ���֣� �������10������ 1��3 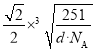 ��������������Ҳ���֣�
��������������Ҳ���֣�![]()
����������1��ͭԭ������Ϊ29����̬ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1��3d�ܼ���û��δ�ɶԵ��ӡ�
��2����Cu2+���ӹ���Ϊ3d9��[Cu(NH3)4]2+Ҳ�ɱ�ʾΪCu(NH3)4(H2O)2]2+��Ϊsp3d2�ӻ���ͬʱ�������䣬�γ��Ķ�(Cu��NH3��λ��)����(H2O��Cu��λ��)��λ��������H2O��Cu��λ������������Ϊ�����ڣ����Ǿͳ���ƽ�����ı��νṹ����[Cu(NH3)4]2+�����У�Cu2+�����չ����NH3�ṩ�¶Ե��ӣ�Cu2+��NH3֮���γ���λ������NH3���ɷ��ӹ��ɵĹ��ۻ�����γɵľ������ڷ��Ӿ��壻Nԭ�ӵ����Ų�ʽΪ1s22s22p3��ֻ��3��δ�ɶԵ��ӣ�����ֻ���γ�3���������
��3��һ������£�Ԫ�ص�ԭ�Ӱ뾶ԽС��Ԫ�صķǽ�����Խǿ��������ܾ�Խ����Nԭ�ӵ�2p�Dz㣨2p3��Ϊ�����������ع����Dz�����ڰ�����ȫ����ȫ��ʱԭ�ӵ������ή�ͣ����ȶ���ʧ���ӽ��ѣ�����Nԭ�ӵĵ�һ�����ܴ���Oԭ�ӵĵ�һ��������
��4������ͭ�������ǽ�������������ͭ���������ɽ������γɵľ�����
��5���پ�����ͭԭ�������ģ���ԭ���ڶ��㣬���ݾ�̯�����㣬������ͭԭ�Ӹ���Ϊ6��![]() ��3����ԭ�ӵĸ���Ϊ8��
��3����ԭ�ӵĸ���Ϊ8��![]() ��1����ͭ����ԭ�Ӹ�����Ϊ3��1���ڸ������Ϸ������þ��������ΪCu3Ni�����Ͻ���ܶ�Ϊdg��cm-3��NAΪ�����ӵ�������ֵ�������ܶ���
��1����ͭ����ԭ�Ӹ�����Ϊ3��1���ڸ������Ϸ������þ��������ΪCu3Ni�����Ͻ���ܶ�Ϊdg��cm-3��NAΪ�����ӵ�������ֵ�������ܶ���![]() ����d=
����d=![]() ��������a��
��������a��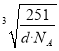 ��������ͼ��ʾ���辧���������D��Niԭ�ӵ����Cuԭ�ӵľ���Ϊx����2x2=a2������x=
��������ͼ��ʾ���辧���������D��Niԭ�ӵ����Cuԭ�ӵľ���Ϊx����2x2=a2������x=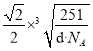 ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤����������ֵ����ش��������⣺
��1��0.5mol SO2������Լ_______��ԭ�ӣ�����_______g SO3������ԭ������ȡ�
��2��������ͬ�Ģ�HCl����NH3����CO2����O2���������У���ͬ��ͬѹ�����£���ռ�����С���ǣ�����ţ�___________��
��3��19gij���۽����Ȼ��ACl2���к���0.4mol Cl-����ACl2��Ħ��������_____��
��4����״����ij��O2��N2�Ļ������m g������b�����ӣ���n g�û����������ͬ״������ռ�����Ӧ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Na3N��3H2O��3NaOH��NH3������NaH��H2O��NaOH��H2��������������ȷ����
A. ���Ӱ뾶��Na+��N3-��H+
B. ��Ӧ����������������ԭ��Ӧ
C. ��Ӧ��ÿ����1 mol H2��ת�Ƶĵ�����ΪNA
D. Na3N��NaH�����ᷴӦ��ֻ����һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeBr2��FeI2�����Һ����ͨ�������������ܷ����ķ�Ӧ���ӷ���ʽ��(����)
A. 2I����Cl2===I2��2Cl��
B. 2Fe2����2Br����2I����3Cl2===2Fe3����I2��Br2��6Cl��
C. 2Fe2����4Br����2I����4Cl2===2Fe3����I2��2Br2��8Cl��
D. 4Fe2����2Br����2I����4Cl2===4Fe3����I2��Br2��8Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaOH����Һ�����ƺͱ궨ʱ���辭��NaOH��Һ�����ơ�������H2C2O4��2H2O�ij����Լ���NaOH��Һ�ζ��Ȳ��������в�����ȷ����( )
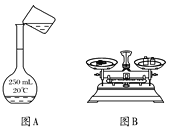
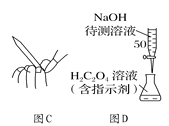
A. ��ͼA��ʾ�ķ���ת��NaOH��Һ������ƿ��
B. ��ͼB��ʾ��װ��ȷ�Ƶ�0.15 g H2C2O4��2H2O
C. ��ͼC��ʾ�IJ����ų���ʽ�ζ����е�����
D. ��ͼD��ʾ��װ�ã���NaOH����Һ�ζ�H2C2O4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 mL Fe2(SO4)3��CuSO4 �Ļ��Һ�������������ӵ�Ũ�Ⱦ�Ϊ2.0 mol��L��1���ּ���a mol�����������Ӧ��������˵������ȷ����(����)
A. ��a��0.5ʱ�������ķ�ӦΪ2Fe3����Fe===3Fe2��
B. ��a��1ʱ�������ķ�ӦΪ2Fe3����Cu2����2Fe===4Fe2����Cu
C. �� 0.5��a��1.5ʱ����Һ��Cu2����Fe2����SO![]() �����ʵ���֮��Ϊ(3��2a)��(2��2a)��5
�����ʵ���֮��Ϊ(3��2a)��(2��2a)��5
D. ��a��1.5ʱ����Ӧ�е���ת����Ŀ����3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƶ���ȷ����
A. pH=6.5����Һһ��������
B. 0.1mol L-1��Na2CO3��Һ�У�c(CO32-)+c(HCO3-)=0.1mol L-1
C. �����£��������0.2 mol L-1��������0.2 mol L-1������������Һ��ϣ�������Һ��pH=13
D. �����£�ij��Һ��ˮ�������c(OH-)=l��10-12 mol L-1������ҺpH һ������2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������( )

A. �� ͼ��֪��a��Kw����ֵ��b��Kw����ֵ��
B. �ұ�ʾ����ͬ���ܱ������У���ͬ�¶��µķ�Ӧ���÷�Ӧ�Ħ�H<0
C. ����ʾ0.100 0 mol��L��1 NaOH��Һ�ζ�20.00 mL 0.100 0 mol��L��1������Һ�ĵζ�����
D. ����ͼ������ȥCuSO4��Һ�е�Fe3�����ɼ���CuO����pH��3��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���巴Ӧ��ƽ�ⳣ���ɱ�ʾΪK=c(CH3OCH3)c(H2O)/c2(CH3OH)���÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ����400����K=32��500����K=44����ش��������⣺
��1��д��������Ӧ�Ļ�ѧ����ʽ��_________________________________ ��
��2���÷�Ӧ����H _________0��
��3����֪���ܱ������У����ijʱ�̸���ֵ�Ũ�����£�
���� | CH3OH(g�� | CH3OCH3(g�� | H2O(g�� |
Ũ��/��molL-1�� | 0.54 | 0.68 | 0.68 |
�ٴ�ʱ�¶�400�棬��ijʱ������_______���������������ͬ����
�������¶�Ϊ�����꣬�Ը��¶���ƽ��̬�״����ʵ���nΪ�����꣬��ʱ��Ӧ����ͼ���λ����ͼ��____�㣬�Ƚ�ͼ��B��D��������Ӧ������Ӧ������B_______��D��������____��

��4��һ��������Ҫ��߷�Ӧ���ת���ʣ����Բ��õĴ�ʩ��___________��
a�������¶� b��������� c��ѹ�����������
d������ˮ������Ũ�� e����ʱ���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com