
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式:_________________________________ 。
(2)该反应的△H _________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中____点,比较图中B、D两点所对应的正反应速率υB_______υD,理由是____。

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物
【答案】 2CH3OH![]() CH3OCH3+H2O > > A < 温度升高,化学反应速率加快 ae
CH3OCH3+H2O > > A < 温度升高,化学反应速率加快 ae
【解析】试题分析:(1)根据气体反应的平衡常数K=c(CH3OCH3)c(H2O)/c2(CH3OH),可得该反应的化学方程式为2CH3OH![]() CH3OCH3+H2O。
CH3OCH3+H2O。
(2)根据400℃,K=32;500℃,K=44,温度升高,K值增大,该反应是吸热反应,△H > 0.
(3)①根据表格提供的数据Q=(0.68×0.68)÷(0.54×0.54)=1.6<K=32,平衡正向移动,υ正 >υ逆;②根据图像,位于图像上的点都是化学平衡点,位于图像上方的点,都需要降低甲醇物质的量达到平衡,即反应正向移动,υ正 >υ逆,所以此时反应点在图象的位置是图中A点,因为温度升高,化学反应速率加快,所以图中B、D两点所对应的正反应速率υB <υD。
(4)a.该反应是吸热反应,升高温度,平衡正向移动,反应物转化率增大,正确;b.加入催化剂,平衡不移动,错误;c.压缩容器的体积,即增大压强,平衡不移动,错误;d.增加水蒸气的浓度,平衡逆向移动,反应物的转化率降低,错误;e.及时分离出产物,平衡正向移动,反应为转化率增大,正确;选ae。


科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
铜镍合金曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)铜元素基态原子的电子排布式为_________,3d能级上的未成对电子数为_________。
(2)氢氧化铜与氨水作用形成[Cu(NH3)4](OH)2深蓝色溶液。
①[Cu(NH3)4](OH)2中阳离子的立体构型是_________。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为_______________,提供孤电子对的成键原子是_______________。
③氨可以形成的晶体属于_______晶体(填晶体类型),其结构中的氮原子只能形成_______个氮氢键,其原因是______________________________________。
(3)N原子的第一电离能IN=l402.3kJ/mol,0原子的第一电离能I0=1313.9kJ/mol。IN>I0的原因是_____________________________。
(4)单质铜及镍都是由__________键形成的晶体。
(5)铜镍合金的立方晶胞结构如图所示。

①晶胞中镍原子与铜原子的数量比为_______。
②若合金的密度为dg/cm3,晶体中任意―个Ni原子到最近Cu原子的距离为_______ cm(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是一种化工原料,有如下转化关系:

已知:

回答下列问题:
(1)A的名称(系统命名)是_____;B→C的反应类型是_________。
(2)B的结构简式是____,D的核磁共振氢谱共有________组峰。
(3)上述物质中互为同系物的是________________(填化合物代号)。
(4)F生成PHB的化学方程式是___________________
(5)E的同分异构体中,既能发生银镜反应,也能与碳酸氢钠溶液反应的共有________种(不考虑立体异构)。
(6)F除了合成PHB外,还可经过_________、酯化、聚合三步反应合成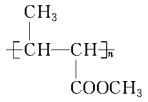 (一种类似有机玻璃的塑料)。在催化剂作用下,第三步反应的化学方程式是___________________。
(一种类似有机玻璃的塑料)。在催化剂作用下,第三步反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲苯可以进行如下转化:

回答下列问题:
(1)反应①的反应类型为__________,反应③的反应类型为_____________。
(2)化合物A的结构简式为____________。化合物D的分子式为_____________。
(3)反应②的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4L HCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρ g/cm3(ρ>1),溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④所得溶液中含有NA个HCl分子.
×100% ②c=1molL﹣1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④所得溶液中含有NA个HCl分子.
A. 全部 B. ①③④ C. ①③ D. 只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于微粒半径的说法正确的是( )
A.电子层数少的元素的原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核粒子,半径相同
C.质子数相同的不同单核粒子,电子数越多半径越大
D.原子序数越大,原子半径越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的价电子排布式为______.
(2)B、X、D氢化物的沸点由高到低的顺序为______(用相应的化学式作答).
(3)E元素是A元素所在周期中电负性最大的,则EO3-的立体构型为______.
(4)F元素基态原子M层上有5对成对电子,F元素的名称为______.F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为______,δ、γ、α三种晶胞的密度之比为______.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用废铜铁合金制取生产油漆的颜料铁红(Fe2O3),并回收铜的流程如下:
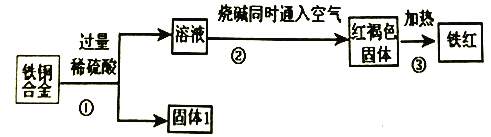
完成下列问题:
(1)上述三个过程中发生了氧化还原反应的是____________(填符号①②③)。
(2)固体1的名称______;红褐色固体的化学式______ 。
(3)写出整个②过程发生反应的离子方程式:______ ;______ ;______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com