
【题目】某工厂用废铜铁合金制取生产油漆的颜料铁红(Fe2O3),并回收铜的流程如下:
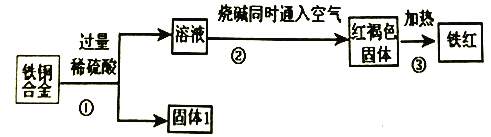
完成下列问题:
(1)上述三个过程中发生了氧化还原反应的是____________(填符号①②③)。
(2)固体1的名称______;红褐色固体的化学式______ 。
(3)写出整个②过程发生反应的离子方程式:______ ;______ ;______ 。
【答案】 ①② 铜 Fe(OH)3 H++OH-=H2O Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+2H2O+O2= 4Fe(OH)3
【解析】废铜铁合金与过量的稀硫酸反应时铁溶解,铜不反应,固体1是铜。溶液中含有硫酸亚铁和硫酸,加入烧碱同时通入空气生成红褐色氢氧化铁沉淀,加热分解生成氧化铁,即制得铁红。
(1)氢氧化铁分解不是氧化还原反应,则上述三个过程中发生了氧化还原反应的是①②。(2)根据以上分析可知固体1的名称铜;红褐色固体是氢氧化铁,化学式为Fe(OH)3。(3)溶液中含有硫酸,首先发生中和反应,然后亚铁离子与氢氧根反应生成氢氧化亚铁沉淀,最后是氢氧化亚铁被氧化为氢氧化铁,则整个②过程发生反应的离子方程式为H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+2H2O+O2=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式:_________________________________ 。
(2)该反应的△H _________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中____点,比较图中B、D两点所对应的正反应速率υB_______υD,理由是____。

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍氢电池具有性能好、寿命长等优点,其反应原理是NiO(OH)+ MH==NiO+M + H2O,MH可理解为储氢合金M中吸收结合氢原子,下列说法不正确的是

A. MH电极是负极
B. OH-向MH极移动
C. 正极电极反应式:NiO(OH)+e-=NiO+OH-
D. 电子从MH电极流向NiO(OH)电极,经KOH溶液流回MH极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种常用的植物调味油,可按如下路线合成:

已知:![]()
回答下列问题:
(1)下列关于乙烯的说法不正确的是_________(填字母)。
a.分子中所有原子共平面
b.能发生氧化反应,不能发生还原反应
c.能发生加聚反应生成高分子
d.能使酸性高锰酸钾溶液褪色
(2)由F生成G的反应类型为_________________________。
(3)C中官能团的名称为___________,由C生成D的反应类型为___________。
(4)D的化学名称为___________,由D生成E的化学方程式为___________。
(5)苯环上含有两个取代基,且分子中含有酯基的F的同分异构体有_________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是__________(填结构简式)。
(6)参照上述合成路线,设计以B为原料(无极试剂任选)制备高吸水性树脂![]() 的合成路线:________________。
的合成路线:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下.体积和pH均相同的氨水和氢氧化钠溶液,加水稀释过程中pH变化如图所示,下列说法正确的是

A. a曲线代表氢氧化钠溶液
B. 分別加水稀释100倍后溶液中的c(H+),氢氧化钠溶液大于氨水
C. 分别加入相同浓度醋酸溶液中和至溶液呈中性,消耗醋酸两者相等
D. 分别与体积、浓度均相同的FeCl3溶液反应,生成沉淀质量一定是氨水多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
A. 砷在通常情况下是固体
B. 可以存在-3、+3、+5等多种化合价
C. As2O5对应水化物的酸性比H3PO4弱
D. AsH3的稳定性比PH3强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得。
请回答下列问题:
(1)二茂铁的熔点是173℃(在100℃时开始升华),沸点是2.19℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为______晶体,由此可进一步推知,在二茂铁结构中,![]() 与Fe2+之间形成的化学键类型是_______;
与Fe2+之间形成的化学键类型是_______;
(2)①写出等物质的量的环戊二烯与溴反应的两个化学方程式____________,
②H2C=CH—C≡C—CH3是环戊二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有______个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com