
【题目】下列推断正确的是
A. pH=6.5的溶液一定显酸性
B. 0.1mol L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol L-1
C. 常温下,等体积的0.2 mol L-1的盐酸与0.2 mol L-1的氢氧化钡溶液混合,所得溶液的pH=13
D. 常温下,某溶液中水电离出的c(OH-)=l×10-12 mol L-1,该溶液pH 一定等于2
【答案】C
【解析】A、没有指明温度,pH=6.5的溶液不一定显酸性,选项A错误;B、根据物料守恒0.1mol L-1的Na2CO3溶液中:c(H2CO3)+c(CO32-)+c(HCO3-)=0.1mol L-1,选项B错误;C、常温下,等体积的0.2 mol L-1的盐酸与0.2 mol L-1的氢氧化钡溶液混合,氢氧化钡过量,所得溶液的c(OH-)=![]() =0.1mol/L,则c(H+)=10-13mol/L,则pH=13,选项C正确;D、常温下某溶液中水电离出的c(H+) = 1×10-12 mol/L,说明该溶液中水的电离是被抑制的,所以溶液可能显酸性,也可能显碱性,pH 可能为2或12,选项D错误。答案选C。
=0.1mol/L,则c(H+)=10-13mol/L,则pH=13,选项C正确;D、常温下某溶液中水电离出的c(H+) = 1×10-12 mol/L,说明该溶液中水的电离是被抑制的,所以溶液可能显酸性,也可能显碱性,pH 可能为2或12,选项D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CCl4的沸点低于SiCl4,其原因是晶体类型不同
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是共价化合物
C. HClO易分解是因为HClO分子间作用力弱
D. 离子化合物中不一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,原溶液中肯定有的离子是_______,离子反应方程式为____________________。
(3)取(2)的滤液加入过量NaOH,出现白色沉淀,说明原溶液中肯定存在的离子有______________。
(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)________。
A.Cl- B.NO3- C.CO32- D.OH-
Ⅱ.(1)向CuCl2溶液中滴加NaOH溶液,现象:________,离子方程式:______________;
(2)向NaHCO3溶液中滴加稀硫酸,现象:________,离子方程式:______________________;
(3)稀硝酸和KOH溶液混合,现象:________,离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
铜镍合金曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)铜元素基态原子的电子排布式为_________,3d能级上的未成对电子数为_________。
(2)氢氧化铜与氨水作用形成[Cu(NH3)4](OH)2深蓝色溶液。
①[Cu(NH3)4](OH)2中阳离子的立体构型是_________。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为_______________,提供孤电子对的成键原子是_______________。
③氨可以形成的晶体属于_______晶体(填晶体类型),其结构中的氮原子只能形成_______个氮氢键,其原因是______________________________________。
(3)N原子的第一电离能IN=l402.3kJ/mol,0原子的第一电离能I0=1313.9kJ/mol。IN>I0的原因是_____________________________。
(4)单质铜及镍都是由__________键形成的晶体。
(5)铜镍合金的立方晶胞结构如图所示。

①晶胞中镍原子与铜原子的数量比为_______。
②若合金的密度为dg/cm3,晶体中任意―个Ni原子到最近Cu原子的距离为_______ cm(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的说法中错误的是( )
A. 氯化钠熔化或氯化氢溶于水时都要破坏化学键
B. 离子化合物中可能含有共价键,共价化合物中一定不含有离子键
C. 氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
D. 碘晶体升华和冰熔化时都未涉及化学键的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质变化的比较中,正确的是
A. 酸性强弱HIO4<HBrO4<HClO4 B. 原子半径大小S>Na>O
C. 碱性强弱KOH<NaOH<LiOH D. 金属性强弱Na<Mg<Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是 ( )

A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol
D. 该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是一种化工原料,有如下转化关系:

已知:

回答下列问题:
(1)A的名称(系统命名)是_____;B→C的反应类型是_________。
(2)B的结构简式是____,D的核磁共振氢谱共有________组峰。
(3)上述物质中互为同系物的是________________(填化合物代号)。
(4)F生成PHB的化学方程式是___________________
(5)E的同分异构体中,既能发生银镜反应,也能与碳酸氢钠溶液反应的共有________种(不考虑立体异构)。
(6)F除了合成PHB外,还可经过_________、酯化、聚合三步反应合成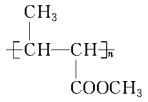 (一种类似有机玻璃的塑料)。在催化剂作用下,第三步反应的化学方程式是___________________。
(一种类似有机玻璃的塑料)。在催化剂作用下,第三步反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于微粒半径的说法正确的是( )
A.电子层数少的元素的原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核粒子,半径相同
C.质子数相同的不同单核粒子,电子数越多半径越大
D.原子序数越大,原子半径越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com